Умеренно выраженный перивентрикулярный отек
Перивентрикулярная лейкомаляция – это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
Общие сведения
По разным данным, перивентрикулярная лейкомаляция (ПВЛ) встречается у 4,8-9% младенцев, причем среди больных преобладают недоношенные новорожденные (78%). Наибольшая вероятность появления болезни у детей, родившихся на сроке 27-32 недели. По данным аутопсии умерших младенцев, признаки ПВЛ регистрируются чаще – у 50-75%. Заболевание имеет большую значимость в детской неврологии, поскольку может вызывать тяжелые отдаленные последствия, считается ведущей причиной ДЦП.
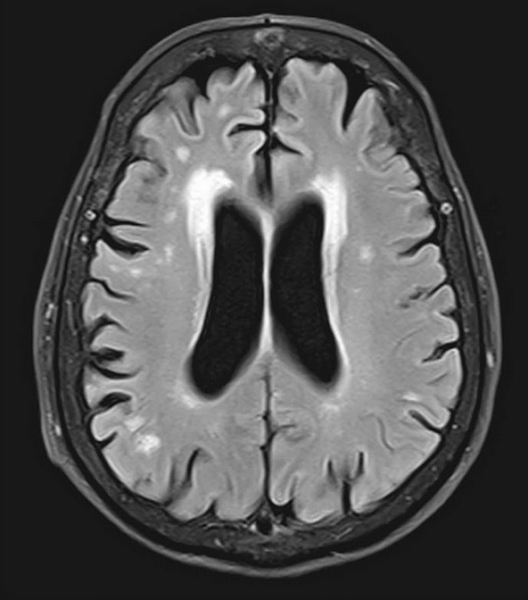
Перивентрикулярная лейкомаляция
Причины
Основной этиологический фактор перивентрикулярной лейкомаляции – внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
При перивентрикулярной лейкомаляции в конечном итоге происходит некроз отельных участков мозгового вещества, образование кист, избыточное накопление медиаторов воспаления. Поскольку на 28-32 неделях в норме происходит активная миелинизация белого вещества, а в условиях гипоксии этот процесс не может происходить, недоношенные новорожденные впоследствии имеют серьезные органические поражения ЦНС.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии – при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика – повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями – повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Течение перивентрикулярной лейкомаляции имеет неравномерный характер: периоды обострения симптоматики сменяются «мнимым благополучием», когда ребенок развивается относительно нормально. Затем происходит задержка формирования моторных навыков, развиваются различные сенсорные нарушения, дизартрия. 66% детей, особенно недоношенные, страдают от снижения остроты зрения вплоть до полной слепоты вследствие атрофии зрительных нервов.
Осложнения
Перивентрикулярные поражения белого вещества – крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще – недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах – спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
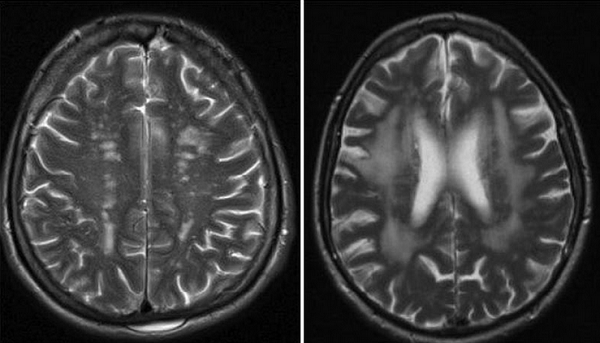
- Нейровизуализация. При КТ и МРТ головного мозга определяются множественные очаги атрофии белого вещества, зачастую визуализируются кисты перивентрикулярной области размером более 4 мм, что коррелирует с тяжелым неврологическим дефицитом.
- Дуплексное сканирование сосудов. Исследование артерий головы и шеи с помощью допплерографии имеет важное значение для уточнения параметров кровотока, исключения сосудистых аномалий, которые могли быть причиной постнатальной гипоксии. По показаниям исследование дополняется реоэнцефалографией.
- ЭЭГ. При судорожном синдроме электроэнцефалография необходима для обнаружения зон мозга с повышенной электрической активностью. Недоношенным новорожденным требуются повторные исследования в разные возрастные периоды для оценки динамики морфофункционального созревания мозга.
- Консультации специалистов. При подозрении на патологию зрения, рекомендуется обследование у офтальмолога с осмотром глазного дна. Больным со сниженным слухом необходима консультация ЛОР-врача. Иногда требуется визит к детскому психологу, психиатру.
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
- Инфузионная терапия. Растворы глюкозы, электролитов, витаминов оказывают положительное влияние на церебральный метаболизм, повышают устойчивость перивентрикулярных зон к гипоксии.
- Нейрометаболиты. Препараты улучшают кровоток и стимулируют доставку питательных веществ в головной мозг, а также выполняют функцию нейропротекторов, способствуют формированию когнитивных навыков.
- Антиконвульсанты. Для купирования судорог используются медикаменты из группы бензодиазепиновых транквилизаторов, а при их неэффективности применяются барбитураты, препараты для наркоза.
- Глюкокортикоиды. Лекарства показаны в случае осложнения заболевания внутричерепной гипертензией. В таком случае они дополняются осмотическими диуретиками.
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.
Источник
Патологические процессы, затрагивающие центральную нервную систему (ЦНС), влияют на работоспособность всего организма. Морфологические изменения зачастую носят необратимый характер, снижая функциональность поврежденных отделов.
Органические поражения головного мозга часто развиваются на фоне нарушения кровоснабжения интракраниального (внутричерепного) пространства. Следствием длительной ишемии нервных тканей может стать лейкоареоз – структурные изменения белого церебрального вещества.

Признаки сосудистого поражения головного мозга
Своевременная диагностика заболевания позволяет стабилизировать работу брахиоцефальных артерий, снизить риск развития опасных осложнений. Эффективным методом исследования головного мозга является магнитно-резонансная томография.
МРТ предполагает использование силового поля, безвредного для здоровья человека. В ответ на направленный электромагнитный импульс наблюдается резонанс заряженных частиц в клетках организма. Атомы водорода в молекулах воды совершают колебательные движения, которые можно зарегистрировать при помощи чувствительных детекторов.
Информативность МР-сканирования зависит от насыщенности жидкостью изучаемых структур. Ткани головного и спинного мозга содержат большой объем воды, поэтому магнитно-резонансная томография позволяет визуализировать малейшие изменения в состоянии ЦНС.
Что такое лейкоареоз?
Причиной развития патологических процессов в области церебрального вещества служит хроническая ишемия головного мозга. При нарушении интракраниального кровообращения возникают очаги некроза нервной ткани. Структурные трансформации сопровождаются уменьшением плотности белого вещества, разрушением миелиновой оболочки нейронов. Процесс передачи нервных импульсов прекращается, снижается функциональность пораженного участка ЦНС.
В зависимости от локализации патологических явлений различают две формы лейкоареоза:
перивентрикулярный – дегенеративные процессы протекают в боковых желудочках головного мозга, возможны очаговые или диффузные изменения паренхимы;
субкортикальный – затрагивает белое вещество под корковым слоем.
Перивентрикулярный лейкоареоз как самостоятельное заболевание встречается редко, чаще данное явление служит симптомом другой патологии головного мозга. Причинами деструктивных процессов считают:
болезнь Альцгеймера;
рассеянный склероз;
болезнь Бинсвангера;
сосудистую деменцию;
ишемический инсульт;
гипертоническую болезнь;
сахарный диабет;
ВИЧ и пр.
Характерным признаком перечисленных патологий является нарушение мозгового кровообращения, приводящее к демиелинизации и дегенерации церебральных структур.
Перивентрикулярный процесс на снимках МРТ
К негативным факторам, повышающим риск развития лейкоареоза, относят:
пожилой возраст;
табакокурение;
алкоголизм;
употребление наркотических средств;
заболевания сердечно-сосудистой системы;
повышенную свертываемость крови;
нерациональное питание.
Перивентрикулярный процесс часто развивается вследствие отека головного мозга, сопровождающегося нарушением функционирования ликвора боковых желудочков. Крупные очаги появляются при лакунарном инфаркте или инсульте.
Симптомы лейкоареоза
Деструкция белого вещества характеризуется нарушением мозговых функций. Клинические проявления зависят от локализации и стадии патологического процесса. Степень поражения нервной ткани определяют с помощью инструментальных исследований. При проведении МРТ возможна диагностика лейкоареоза на начальном этапе.
Для клинической картины деструкции головного мозга характерны:
моторная дисфункция;
когнитивные нарушения;
расстройство психо-эмоционального фона;
нарушения речи;
мышечная слабость;
головные боли;
бессонница.
Первая стадия лейкоареоза сопровождается незначительными головокружениями, быстрой утомляемостью, слабостью. Пациент отмечает:
шум в ушах;
снижение концентрации внимания;
общее депрессивное состояние.
Возможны речевые нарушения, ослабление памяти. При осмотре выявляют повышение сухожильных рефлексов.
Вторая стадия протекает со значительным снижением функциональности организма. Отмечают:
нарушение координации движений;
потерю равновесия при ходьбе;
замедление психомоторных функций;
частичную или полную утрату речи;
снижение памяти и внимания.
Пациент перестает контролировать свои действия. Заметны апатия, раздражительность, депрессия. Возможны учащенное мочеиспускание, ночной диурез.
Третья стадия сопровождается усилением перечисленных признаков. Наблюдаются:
выраженные поведенческие нарушения;
падения при ходьбе;
утрата речи, памяти;
недержание мочи.
Пациент не способен к самообслуживанию.
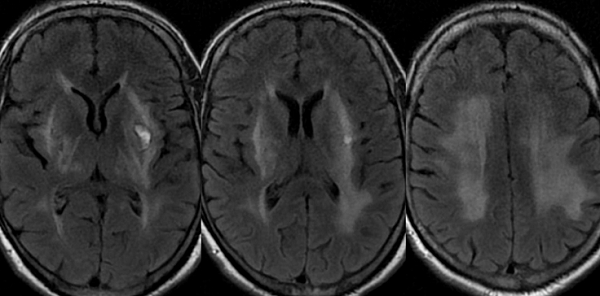
Лейкоареоз на снимках МРТ
Деструкция белого вещества в области лобной доли характеризуется снижением интеллектуальных способностей на фоне удовлетворительной моторной функции.
МРТ головного мозга покажет лейкоареоз?
Магнитно-резонансную томографию считают одним из наиболее информативных способов исследования церебральных структур. В результате МРТ получают послойные изображения с шагом от 1 мм.
Сканирование проводят в трех взаимно перпендикулярных проекциях, при необходимости врач реконструирует 3D-модель рассматриваемой области. Томограммы визуализируют строение, форму, размеры интракраниальных структур. Трехмерная проекция помогает оценить локализацию и распространенность патологического процесса.
Изменения, характерные для лейкоареоза, хорошо видны при МРТ головного мозга. Метод позволяет оценить состояние белого вещества, показывает нарушение целостности миелинового слоя нейронов. Для визуализации кровеносной системы назначают МР-ангиографию.
Исследование церебральных сосудов проводят с использованием контрастного препарата. После внутривенной инъекции раствор заполняет кровеносное русло и межклеточное пространство. Томограммы дают возможность оценить просвет, наполненность, состояние стенок сосудов. В результате ангиографии выявляют патологии церебральных вен и артерий, последствия нарушений мозгового кровообращения (ишемию и пр.)
Сканирование применяют для дифференциальной диагностики дегенеративно-дистрофических, воспалительных, демиелинизирующих процессов, следствием которых может стать деструкция белого вещества. МРТ показывает структурные изменения тканей головного мозга, помогая выявлять пораженные очаги диаметром от 3 мм.
Магнитно-резонансная томография позволяет определить лейкоареоз на начальном этапе, уточнить патогенез заболевания и выбрать результативный метод лечения. Эффективность терапевтических и хирургических мер во многом зависит от этиологии деструктивного процесса.
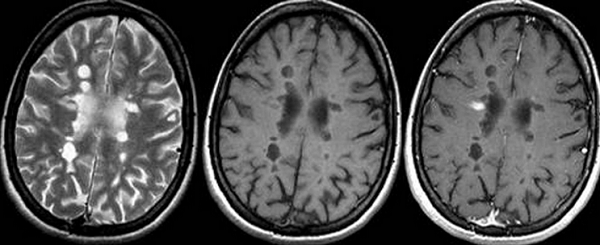
Признаки легкого перивентрикулярного лейкоареоза на МРТ
Заболевание развивается на фоне увеличения количества жидкости вокруг боковых желудочков головного мозга. Расширение периваскулярной щели сопровождается образованием патологических очагов вследствие инсульта или инфаркта. Наблюдается нарушение кровотока церебральных артерий.
При проведении МРТ выявляют следующие признаки лейкоареоза:
вдоль перивентрикулярного пространства заметна равномерная полоса;
над полюсом бокового желудочка образуется «шапочка», соответствующая пораженному участку белого вещества.
На Т2-взвешенных изображениях патологические очаги имеют гиперинтенсивный сигнал.

Изменения в области боковых желудочков при перивентрикулярном лейкоарезе
Клиника «Магнит» в Санкт-Петербурге проводит МРТ головного мозга на закрытом томографе фирмы Siemens. Устройство генерирует силовое поле напряженностью 1,5 Тл, обеспечивая высокое качество снимков. Записаться на исследование можно по телефону +7 (812) 407-32-31 или на сайте клиники.
Источник
Отек головного мозга – стремительно развивающееся накопление жидкости в церебральных тканях, без оказания адекватной медицинской помощи приводящее к смертельному исходу. Основу клинической картины составляет постепенно или быстро нарастающее ухудшение состояния больного и углубление расстройств сознания, сопровождающееся менингеальными знаками и мышечной атонией. Подтверждают диагноз данные МРТ или КТ головного мозга. Дополнительное обследование осуществляется для поиска причины отека. Терапия начинается с дегидратации и поддержания метаболизма церебральных тканей, сочетается с лечением причинного заболевания и назначением симптоматических препаратов. По показаниям возможно срочное (декомпрессионная трепанация, вентрикулостомия) или отсроченное (удаление объемного образования, шунтирование) хирургическое лечение.
Общие сведения
Набухание головного мозга было описано еще в 1865 году Н.И. Пироговым. На сегодняшний день стало понятно, что отек головного мозга не является самостоятельной нозологической единицей, а представляет собой вторично развивающийся патологический процесс, возникающий как осложнение целого ряда заболеваний. Следует отметить, что отек любых других тканей организма – достаточно часто встречающееся явление, совсем не относящееся к ургентным состояниям. В случае головного мозга, отек является жизнеугрожающим состоянием, поскольку, находясь в замкнутом пространстве черепа, церебральные ткани не имеют возможности увеличиваться в объеме и оказываются сдавленными. Вследствие полиэтиологичности отека мозга, в своей практике с ним сталкиваются как специалисты в области неврологии и нейрохирургии, так и травматологи, неонатологи, онкологи, токсикологи.
Отек головного мозга
Причины отека головного мозга
Наиболее часто отек головного мозга развивается при травмировании или органическом поражении его тканей. К таким состояниям относятся: тяжелая ЧМТ (ушиб головного мозга, перелом основания черепа, внутримозговая гематома, субдуральная гематома, диффузное аксональное повреждение, операции на головном мозге), обширный ишемический инсульт, геморрагический инсульт, субарахноидальное кровоизлияние и кровоизлияние в желудочки, первичные опухоли головного мозга (медуллобластома, гемангиобластома, астроцитома, глиома и др.) и его метастатическое поражение. Отек церебральных тканей возможен как осложнение инфекционных заболеваний (энцефалита, менингита) и гнойных процессов головного мозга (субдуральной эмпиемы).
Наряду с внутричерепными факторами к отеку мозга может привести анасарка, возникшая вследствие сердечной недостаточности, аллергические реакции (отек Квинке, анафилактический шок), острые инфекции (токсоплазмоз, скарлатина, свиной грипп, корь, паротит), эндогенные интоксикации (при тяжелом течении сахарного диабета, ОПН, печеночной недостаточности), отравления различными ядами и некоторыми медикаментами.
В отдельных случаях отек головного мозга наблюдается при алкоголизме, что связано с резко повышенной сосудистой проницаемостью. У новорожденных отек мозга бывает обусловлен тяжелым токсикозом беременной, внутричерепной родовой травмой, обвитием пуповиной, затяжными родами. Среди любителей высокогорного спорта встречается т. н. «горный» отек мозга, являющийся результатом слишком резкого набора высоты без необходимой акклиматизации.
Патогенез
Основным звеном в развитии церебрального отека выступают микроциркуляторные нарушения. Первоначально они, как правило, возникают в области очага поражения мозговой ткани (участка ишемии, воспаления, травмы, кровоизлияния, опухоли). Развивается локальный перифокальный отек головного мозга. В случаях тяжелого поражения головного мозга, не проведения своевременного лечения или отсутствия должного эффекта последнего, возникает расстройство сосудистой регуляции, ведущее к тотальному расширению церебральных сосудов и подъему внутрисосудистого гидростатического давления. В результате жидкая часть крови пропотевает через стенки сосудов и пропитывает церебральную ткань. Развивается генерализованный отек головного мозга и его набухание.
В описанном выше процессе ключевыми компонентами являются сосудистый, циркуляторный и тканевой. Сосудистым компонентом выступает повышенная проницаемость стенок мозговых сосудов, циркуляторным – артериальная гипертензия и расширение сосудов, которые приводят к многократному повышению давления в церебральных капиллярах. Тканевой фактор заключается в склонности тканей головного мозга при недостаточности кровоснабжения накапливать жидкость.
В ограниченном пространстве черепной коробки 80-85% объема приходится на церебральные ткани, от 5 до 15% – на цереброспинальную жидкость (ликвор), около 6% занимает кровь. У взрослого нормальное внутричерепное давление в горизонтальном положении варьирует в пределах 3-15 мм рт. ст. Во время чихания или кашля оно ненадолго поднимается до 50 мм рт. ст., что не вызывает расстройств функционирования ЦНС. Отек головного мозга сопровождается быстро нарастающим повышением внутричерепного давления за счет увеличения объема церебральных тканей. Происходит сдавление сосудов, что усугубляет микроциркуляторные нарушения и ишемию мозговых клеток. Вследствие метаболических нарушений, в первую очередь гипоксии, возникает массовая гибель нейронов.
Кроме того, резкая внутричерепная гипертензия может приводить к дислокации нижележащих церебральных структур и ущемлению ствола мозга в большом затылочном отверстии. Нарушение функции находящихся в стволе дыхательного, сердечно-сосудистого и терморегуляторного центров является причиной многих летальных исходов.
Классификация
В связи с особенностями патогенеза отек головного мозга подразделяется на 4 типа: вазогенный, цитотоксический, осмотический и интерстициальный. Самым часто встречающимся типом является вазогенный отек головного мозга, в основе которого лежит повышение проницаемости гематоэнцефалического барьера. В патогенезе основную роль играет переход жидкости из сосудов в белое мозговое вещество. Вазогенный отек возникает перифокально в зоне опухоли, абсцесса, ишемии, оперативного вмешательства и т. п.
Цитотоксический отек мозга является результатом дисфункции глиальных клеток и нарушений в осморегуляции мембран нейронов. Развивается преимущественно в сером мозговом веществе. Его причинами могут выступать: интоксикации (в т. ч. отравление цианидами и угарным газом), ишемический инсульт, гипоксия, вирусные инфекции.
Осмотический отек головного мозга возникает при повышении осмолярности церебральных тканей без нарушения работы гематоэнцефалического барьера. Возникает при гиперволемии, полидипсии, утоплении, метаболических энцефалопатиях, неадекватном гемодиализе. Интерстициальный отек появляется вокруг церебральных желудочков при пропотевании через их стенки жидкой части ликвора.
Симптомы отека головного мозга
Ведущим признаком отека мозга является расстройство сознания, которое может варьировать от легкого сопора до комы. Нарастание глубины нарушения сознания свидетельствует о прогрессировании отека. Возможно, что дебютом клинических проявлений будет потеря сознания, отличающаяся от обычного обморока своей длительностью. Зачастую прогрессирование отека сопровождается судорогами, которые через короткий промежуток времени сменяются мышечной атонией. При осмотре выявляются характерные для менингита оболочечные симптомы.
В случаях, когда отек головного мозга возникает на фоне хронической или постепенно развивающейся острой церебральной патологии, сознание больных в начальном периоде может быть сохранено. Тогда основной жалобой выступает интенсивная головная боль с тошнотой и рвотой, возможны двигательные нарушения, зрительные расстройства, дискоординация движений, дизартрия, галлюцинаторный синдром.
Грозными признаками, свидетельствующими о сдавлении ствола мозга, являются: парадоксальное дыхание (глубокие вдохи наряду с поверхностными, вариативность временных промежутков между вдохами), резкая артериальная гипотония, нестабильность пульса, гипертермия свыше 40°C. Наличие расходящегося косоглазия и «плавающих» глазных яблок говорит о разобщении подкорковых структур от коры головного мозга.
Диагностика отека мозга
Заподозрить отек мозга неврологу позволяет прогрессирующее ухудшение состояния пациента и нарастание нарушения сознания, сопровождающиеся менингеальными симптомами. Подтверждение диагноза возможно при помощи КТ или МРТ головного мозга. Проведение диагностической люмбальной пункции опасно дислокацией церебральных структур со сдавлением мозгового ствола в большом затылочном отверстии. Сбор анамнестических данных, оценка неврологического статуса, клинический и биохимический анализ крови, анализ результатов нейровизуализирующего исследования – позволяют сделать заключение относительно причины отека мозга.
Поскольку отек мозга является угрентным состоянием, требующим неотложной медицинской помощи, его первичная диагностика должна занимать минимум времени и проводиться в стационарных условиях на фоне лечебных мероприятий. В зависимости от ситуации она осуществляется в условиях реанимационного отделения или отделения интенсивной терапии.
Лечение отека головного мозга
Приоритетными направлениями в терапии отека мозга выступают: дегидратация, улучшение церебрального метаболизма, устранение первопричины отека и лечение сопутствующих симптомов. Дегидратационная терапия имеет целью выведение избытка жидкости из церебральных тканей. Она осуществляется путем внутривенных инфузий маннита или других осмотических диуретиков с последующим назначением петлевых диуретиков ( торасемида, фуросемида). Дополнительное введение 25% р-ра магния сульфата и 40% р-ра глюкозы потенцирует действие диуретиков и снабжает церебральные нейроны питательными веществами. Возможно применение L-лизина эсцината, который обладает способностью выводить жидкость, хотя и не является мочегонным препаратом.
С целью улучшения церебрального метаболизма проводится оксигенотерапия (при необходимости – ИВЛ), местная гипотермия головы, введение метаболитов (мексидола, кортексина, цитиколина). Для укрепления сосудистой стенки и стабилизации клеточных мембран применяют глюкокортикостероиды (преднизолон, гидрокортизон).
В зависимости от этиологии отека мозга в его комплексное лечение включают дезинтоксикационные мероприятия, антибиотикотерапию, удаление опухолей, ликвидацию гематом и участков травматического размозжения головного мозга, шунтирующие операции (вентрикулоперитонеальное дренирование, вентрикулоцистерностомию и др.). Этиотропное хирургическое лечение, как правило, проводят только на фоне стабилизации состояния пациента.
Симптоматическая терапия направлена на купирование отдельных проявлений заболевания, осуществляется путем назначения противорвотных средств, антиконвульсантов, обезболивающих препаратов и т. п. По показаниям в ургентном порядке с целью уменьшения внутричерепного давления нейрохирургом может быть проведена декомпрессивная трепанация черепа, наружное вентрикулярное дренирование, эндоскопическое удаление гематомы.
Прогноз
В начальной стадии отек мозга представляет собой обратимый процесс, по мере прогрессирования он приводит к необратимым изменениям мозговых структур – гибели нейронов и деструкции миелиновых волокон. Быстрое развитие указанных нарушений обуславливает то, что полностью ликвидировать отек с 100% восстановлением мозговых функций удается лишь при его токсическом генезе у молодых и здоровых пациентов, вовремя доставленных в специализированное отделение. Самостоятельная регрессия симптомов наблюдается лишь при горном отеке мозга, если удалась своевременная транспортировка больного с высоты, на которой он развился.
Однако в подавляющем большинстве случаев у выживших пациентов наблюдаются остаточные явления перенесенного отека головного мозга. Они могут значительно варьировать от малозаметных окружающим симптомов (головной боли, повышенного внутричерепного давления, рассеянности, забывчивости, нарушений сна, депрессии) до выраженных инвалидизирующих расстройств когнитивных и двигательных функций, психической сферы.
Источник
