Строма с признаками отека


Гиперплазия – это увеличение количества клеток без увеличения их размеров. Гиперпластические процессы могут предшествовать развитию онкологического заболевания. Гиперплазия эндометрия – одна из форм патологических пролиферативных изменений эндометрия, с преимущественной пролиферацией железистого компонента по сравнению со стромальным компонентом [1].
Существует гистологическая классификация гиперпластических процессов эндометрия, предложенная ВОЗ (2014) [2]:
- гиперплазия без атипии (железисто-кистозная гиперплазия эндометрия);
- атипичная гиперплазия: аденоматоз, диффузная или очаговая аденоматозная гиперплазия, аденоматозные полипы;
- полипы эндометрия: железистые, железисто-кистозные, железисто-фиброзные.
Гиперплазия эндометрия без атипии – это пролиферация с изменением строения желез и клеток, но без клеточной атипии. Изменения в строении обычно видны при малом увеличении, но важной особенностью, которая определяет прогноз и возможность малигнизации – это клеточная атипия. Все типы гиперплазии характеризуются увеличением отношения железы к строме, неравномерностью формы железы и изменением размера железы (рис. 1 а и б). При гиперплазии без атипии железистый эпителий напоминает пролиферирующий эндометрий (рис. 1 б). Клетки столбчатые с амфофильной цитоплазмой и имеют псевдостратифицированные ядра, ориентированы к базальной мембране и имеют овальную форму с гладкими контурами, равномерно распределенный хроматин и небольшие незаметные ядрышки. Митотическая активность может быть переменной и может быть меньше, чем в пролиферирующем эндометрии. Частота митоза не влияет на диагноз [5].
Как правило, гиперплазия диффузная, но может быть очаговой из-за локальных различий в содержании рецепторов эстрогена и прогестерона в эндометрии. При простой гиперплазии присутствует строма в значительном объеме. Строение стромы напоминает нормальное, характерное для пролиферативной фазы, строма состоит из маленьких овальных клеток со скудной цитоплазмой. Как и в железах, в строме отмечена митотическая активность. Когда гиперплазия является полипоидной, строма может содержать артерии с толстой стенкой, подобные тем, которые наблюдаются в полипах. По мере прогрессирования гиперплазии железы располагаются более тесно. Обычно железы плотно прилегают друг к другу, хотя всегда присутствует небольшое количество стромы между ними [5].
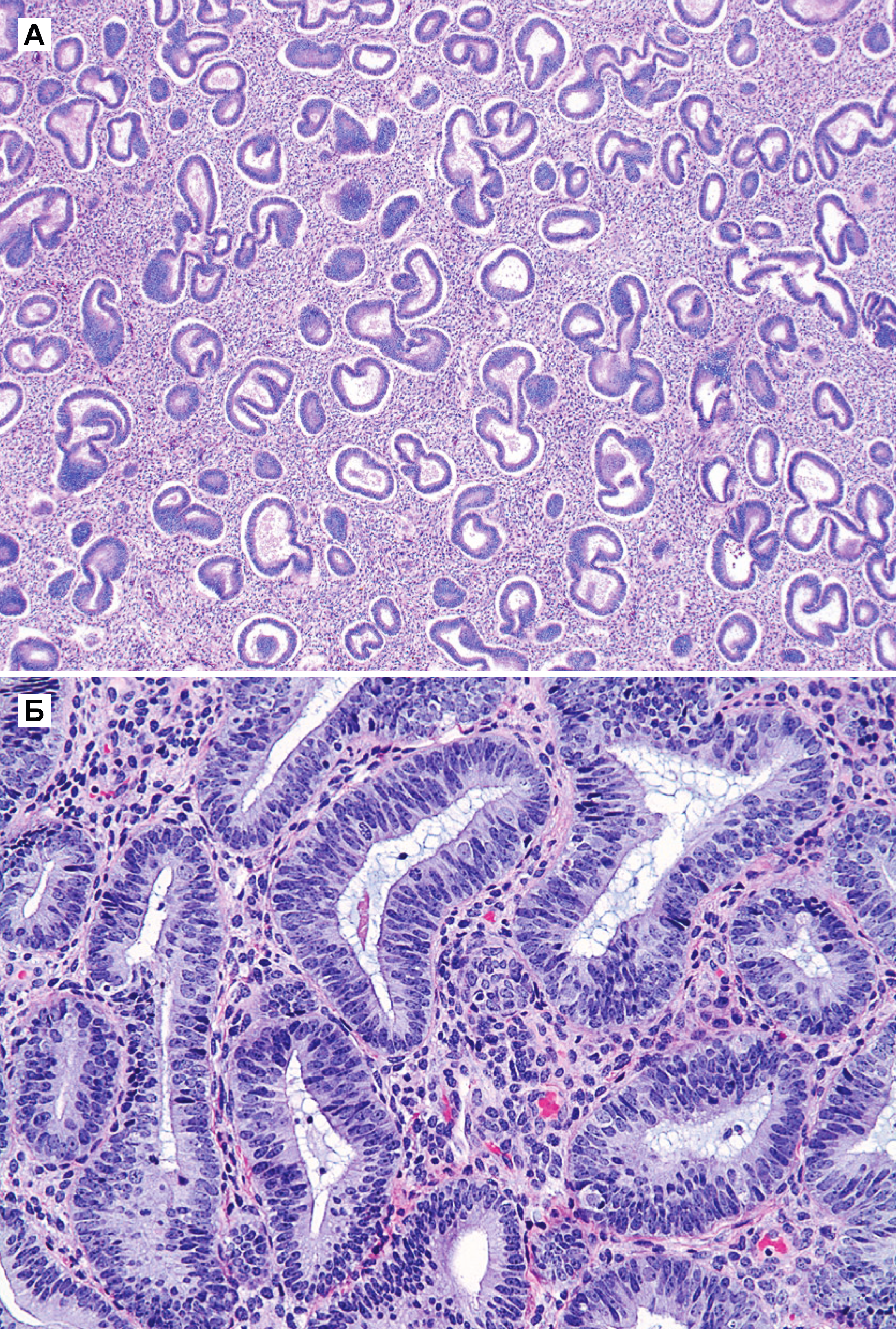
Рисунок 1 | Гиперплазия без атипии [5]
а) Гиперплазия без атипии. Немногочисленные железы, имеющие различия в размерах и форме, разделены обильной стромой. Некоторые железы расширены и слегка кистозные.
б) Ядра железистых клеток имеют овальную форму, псевдостратифицированы и с однородными контурами, признаков клеточной атипии нет, ядра ориентированы к базальной мембране. Ядрышки нечеткие. Как железистые, так и стромальные клетки имеют сходное строение с клетками эндометрия в пролиферативной фазе. Видно несколько митотических фигур.
К предраковым заболеваниям эндометрия относятся [2]:
- атипическая гиперплазия эндометрия (аденоматоз и аденоматозные полипы);
- рецидивирующая железистая гиперплазия эндометрия.
Эндометрий – мишень половых гормонов, так как эта ткань имеет специфические рецепторы. Клетки эндометрия обновляются ежемесячно под влиянием гормональной регуляции. Нарушение гормонального статуса женщины может изменять рост и дифференцировку клеток. Поэтому могут возникнуть гиперпластические процессы [2].
Причины [2]:
- нарушение центральной регуляции репродуктивной системы, вызывающие недостаточность лютеиновой фазы и ановуляция;
- гиперпластические процессы и гормональные опухоли яичников;
- нарушения тканевой рецепции и метаболизма половых гормонов;
- болезни обмена и эндокринной системы (СД, ожирение);
- заболевания гепатобиллиарной системы, ЖКТ, иммунной системы и щитовидной железы.
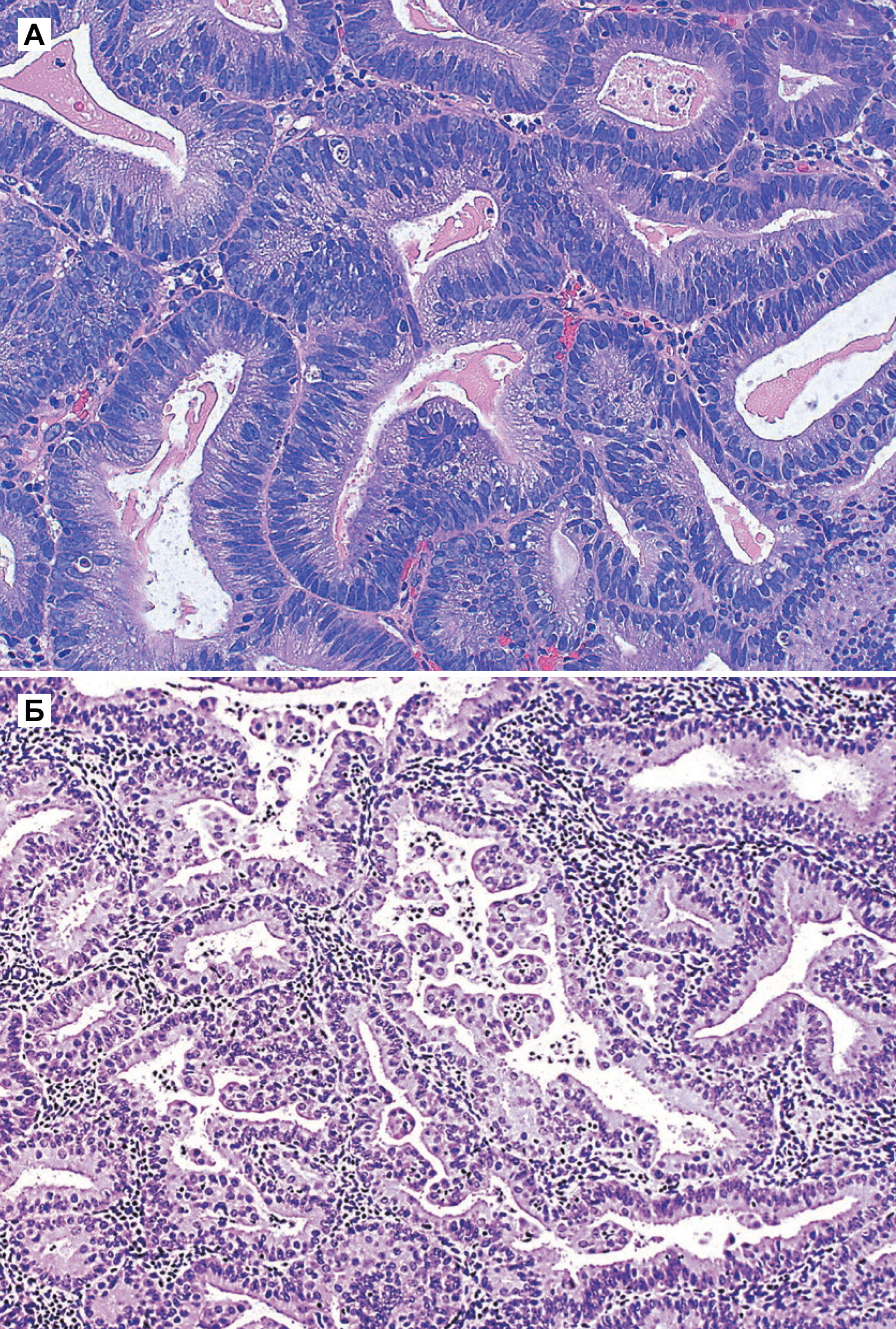
Рисунок 2 | Атипичная гиперплазия [5].
а) Атипичная гиперплазия / EIN (эндометриальная интраэпителиальная неоплазия). Железы немногочисленные, но небольшое количество стромы охватывает каждую железу. Среди клеток заметна ядерная атипия с несколькими слоистыми округлыми ядрами. Видны апоптотические тела.
б) Железы близко расположены, но каждая железа окружена стромой с базальной мембраной. Папиллярные пучки эозинофильных клеток проецируются в просвет многих желез. В строме отмечается плотный воспалительный инфильтрат.
Атипичная гиперплазия отличается наличием ядерной атипии и сложным строением с тесно расположенными железами. Железы обычно неправильной формы и размера. Каждая железа имеет базальную мембрану, окруженную тонким слоем стромы, отделяющей его от соседних желез. Однако в некоторых случаях железы расположены далеко друг от друга. Встречаются как железы без клеточной атипии, так и атипичные [5].
Специфические особенности при атипичной гиперплазии включают: стратификацию, увеличение размера ядер с измененным хроматином и ядрышками. В ядрах отмечена истинная стратификация (2-4 слоя), и потеря ориентирования к базальной мембране [5].
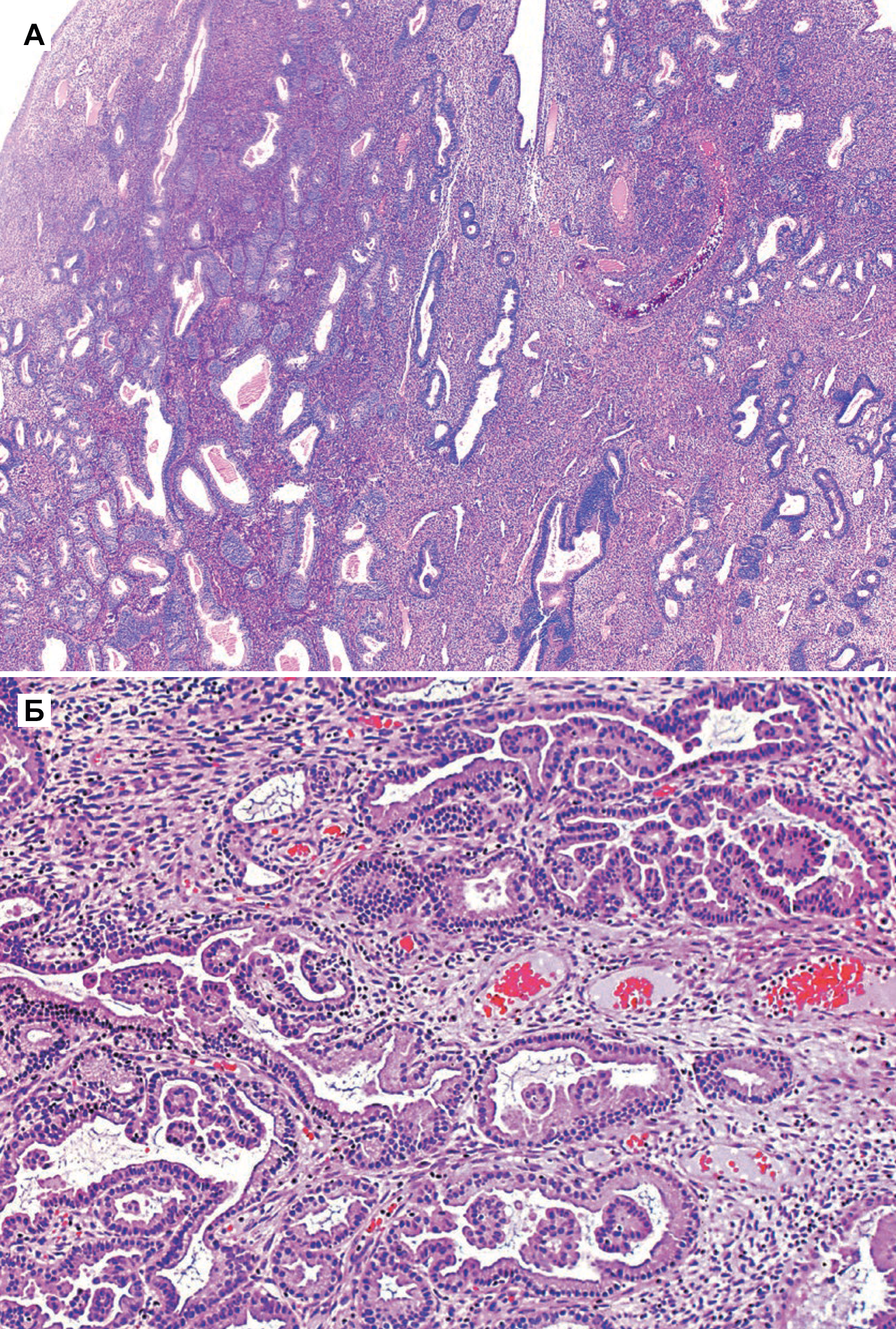
Рисунок 3 | Гиперплазия в полипе эндометрия [5].
а) Хотя в доброкачественном полипе (справа) всегда ожидается сближение желез, иногда обычная гиперплазия с близко расположенными железами включает полип (слева)
б) Очаговая пролиферация в доброкачественном полипе эндометрия. В просвете небольшие папиллярные пучки. Атипии нет.
На фоне гиперпластических процессов в эндометрии, возникающих при длительной пролиферации желез эндометрия без перехода их в секреторную фазу, может развиваться рак тела матки (РТМ) – это злокачественная опухоль, происходящая из слизистой оболочки тела матки (эндометрия). Чаще всего РТМ носит спорадический характер, и в 5 % случаев РТМ ассоциирован с наследственными синдромами, например, с синдромом Линча. Среди факторов риска: гиперэстрогения, ранние менархе, отсутствие родов в анамнезе, поздняя менопауза, возраст старше 55 лет, применение тамоксифена [3].
Эпидемиология РТМ
РТМ – самая частая злокачественная опухоль женских половых органов в развитых странах и вторая по частоте после рака шейки матки злокачественная опухоль женских половых органов в мире. В США в 2015 г. зарегистрировано более 54800 новых случаев заболевания РТМ, и более 10150 смертей от этого заболевания. В России ежегодно регистрируется более 21 тысячи больных РТМ. В структуре заболеваемости женского населения в России в 2016 г. РТМ занимал 3-е ранговое место (7,7 %). Средний возраст заболевших РТМ в России составляет 62,6 года [3,4].
Патогенез
Развитие РТМ обусловлено гиперэстрогенией, основной причиной которой является нарушение овуляции. Клиническое изучение метаболических нарушений у больных раком тела матки и морфологические особенности рака эндометрия позволили обосновать концепцию о двух основных патогенетических вариантах заболевания [2].
I тип (более частый). Опухоль развивается в более молодом возрасте, в отличие от пациенток II патогенетического варианта, на фоне длительной гиперэстрогении и гиперплазии эндометрия. У больных РТМ I патогенетического типа часто наблюдаются ожирение, сахарный диабет и гипертоническая болезнь, возможны эстрогенсекретирующие опухоли яичников или синдром склерокистозных яичников. Опухоли I патогенетического варианта, как правило, высокодифференцированные, имеют более благоприятный прогноз [2].
II тип. Опухоли эндометрия обычно низкодифференцированные, имеют менее благоприятный прогноз. Опухоли II патогенетического типа возникают в более старшем возрасте, в отсутствие гиперэстрогении, на фоне атрофии эндометрия. Примерно у 80% больных РТМ диагностируют эндометриоидную аденокарциному [2].
Выделяют три степени дифференцировки аденокарциномы эндометрия [2]:
G1 – высоко дифференцированная;
G2 – умеренно дифференцированная;
G3 – низко дифференцированная или недифференцированная.
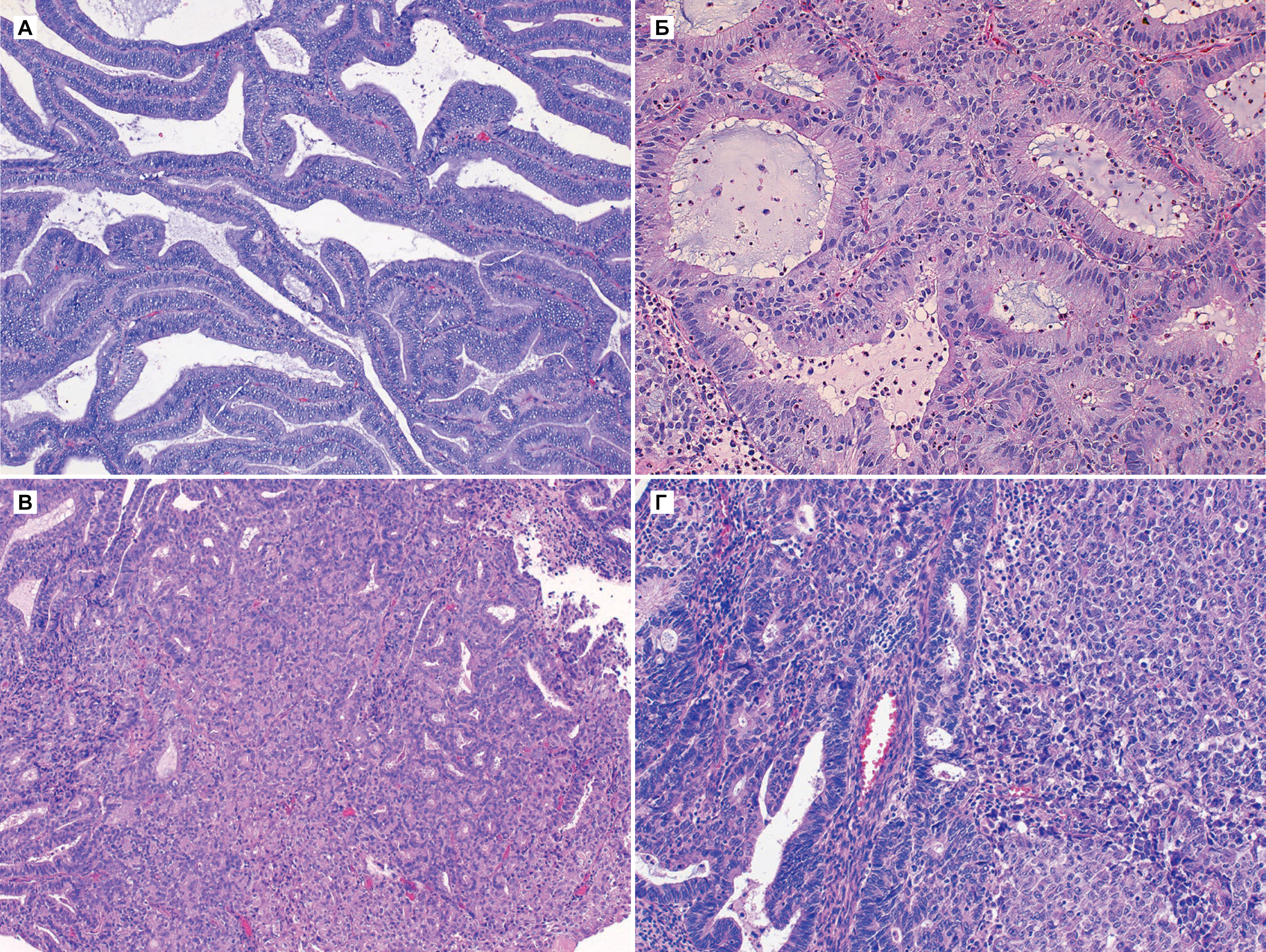
Рисунок 4 | Аденокарцинома эндометрия [4].
а) Эндометриоидная карцинома, G1.
В новообразовании видны хорошо сформированные железы, иногда они сливаются. Ядра с минимальным плеоморфизмом, небольшими ядрышками и низкой скоростью митоза.
б) Железы смыкаются, хотя контуры некоторых желез все еще можно проследить. Это свидетельствует о нарушении стромы
в) Эндометриоидная карцинома, G2. Несмотря на то, что прослеживается дифференцирование желез, в значительной части (примерно 30 %) опухоли наблюдается устойчивый рост.
г) Эндометриоидная карцинома, G3. Присутствует несколько желез, более 50 % клеток опухоли характеризуются устойчивым ростом злокачественных эпителиальных клеток.
Клиника
Ранний симптом прогрессирования рака эндометрия – появление жидких водянистых белей, нередко с примесью крови, и зуда наружных половых органов. Кровянистые выделения из половых путей бывают в виде мажущих серозно-кровянистых выделений, которые становятся порой обильными. Кровотечение, как правило, контактное или появляется после физической нагрузки [2].
Возможны боли внизу живота, которые на ранних стадиях рака носят схваткообразный характер. Это связано с сокращениями эндометрия и опорожнением матки от скопившейся в ней крови или гноевидной жидкости (гематометра, пиометра), отток которой в результате обтурации внутреннего зева затруднен. После таких схваткообразных болей появляются обильные выделения из матки – гной и кровь. При поздних стадиях боли постоянные, особенно интенсивные по ночам, связаны со сдавлением раковым инфильтратом нервных сплетений в малом тазу. При переходе процесса на мочевой пузырь и прямую кишку появляются симптомы нарушения функционирования этих органов [2].
Хирургическое вмешательство рекомендуется как наиболее эффективный метод лечения РТМ независимо от стадии как самостоятельно, так и в комбинации с другими методами [6].
Список литературы:
- Gallos I. D. et al. Management of Endometrial Hyperplasia. Green-top Guideline No. 67. – 2016.
- Радзинский В.Е. Гинекология// под ред. В.Е. Радзинского, А.М. Фукса – М.:ГЭОТАР-Медиа, 2016. – 1000 с.
- Siegel RL., Miller KD., Jemal A. Cancer istics, 2015. // CA Cancer J Clin. – 2015. – V. 65, N 1. – P. 5-29.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2016 г. (заболеваемость и смертность) // М.: МНИОИ им. П.А.Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
- Murdock T. A. et al. Precursors of Endometrial Carcinoma //Diagnosis of Endometrial Biopsies and Curettings. – Springer, Cham, 2019. – С. 225-259.
- Amanta F., Mirzab M., Creutzbergc C. FIGO cancer report 2012. Cancer of the corpus uteri. // Int J Gynecol Obstet. – 2012. – V. 119, S 2. – P. S110-S117.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Гастроинтестинальные стромальные опухоли (ГИСО, ГИСТ) появились чуть больше 20 лет назад, когда усовершенствовали электронный микроскоп, их выделили из компании разнообразных лейомиом. ГИСТ – русскоязычная аббревиатура с английского. Это опухоли зрелого возраста, до 40 лет они встречаются очень редко, преобладают мужчины в середине седьмого десятка жизни. Предполагается, что заболеваемость не растет, просто диагностика стала лучше.

Причина стромальных опухолей
Стромальные опухоли происходят из мезенхимы, из которой у зародыша формируется соединительная ткань и мышцы, некоторые оболочки сосудов и кожа. Причина ГИСО – сбой в формировании гладкомышечной ткани. Подозревают, что родоначальником ГИСО становятся клетки, отвечающие за ритмичное сокращение – перистальтику органов желудочно-кишечного тракта. Они обладают электрической активностью и переносят возбуждение с нервного волокна на мышечное, поэтому носят сложное имя «возбудимые интерстициальные клетки Кахала». ГИСТ и клетки Кахала похожи по строению и обладают мутировавшим геном c-kit, кодирующим синтез определенного белка.
В ГИСО белок отвечает за все жизненно важные процессы, а поскольку он регулирует образование и жизнь опухолевых клеток, он становится онкобелком. Мутировавший с-KIT имеется в 95 из сотни гастроинтестинальных стромальных новообразований. ГИСО не наследуются, не имеют «своего предрака», возникают на фоне полного здоровья, не существует факторов риска. Если вы эпизодически ощущаете желудочный дискомфорт, пройдите обследование в Европейской онкологической клинике, специалисты которой знают всю патологию ЖКТ.
Диагностика ГИСО
В диагностике ГИСО возможности клиники определяют всё – нет возможностей – нет такого заболевания. Идеально сочетание эндоскопии с УЗИ – эндосонография, которая позволяет видеть внутри и за пределами желудка – состояние рядом находящихся структур и всю толщину желудочной стенки.
Главный диагностический критерий – иммуногистохимическое выделение в опухолевых клетках онкобелка KIT (CD117). Этот онкобелок синтезируют мелкоклеточный рак легкого и глиобластома, лейкоз из тучных клеток, метастазы меланомы и сосудистые образования, то есть возможен ложноположительный ответ при не гастроинтестинальной стромальной опухоли, к примеру, при поражении желудка или кишки лейкозом.
Дикими называют стромальные опухоли без с-KIT, таких пять на сотню всех гастроинтестинальных новообразований, внешне они ничем не отличаются от положительных по с-KIT, но течение и реакция на лекарственные препараты у них другая. Поскольку при диагностике с-KIT определяется только в двух экзонах из четырех, но в двух не исследуемых он может быть. В диких опухолях возможна мутация альфа-PDGFR или рецептора инсулинового фактора роста (IGF1R). Когда вообще не находят ни единого маркера, то выполняется молекулярно-генетический анализ, он способен выделить стромальную опухоль, негативную по всем известным критериям диагностики.
ГИСО растет под неизмененной слизистой, заметить маленький узел может только специалист с большим опытом наблюдения стромальных образований.
Симптомы стромальных опухолей желудка
Каждую пятую опухоль обнаруживают случайно при обследовании по другому поводу, узел же может постигать трети метра, ничем серьезным себя не проявляя. Причина частого бессимптомного течения – подслизистый рост, когда опухоль распластывается в стенке и выбухает наружу – в брюшную полость. К моменту обнаружения стромального образования у каждого третьего уже выявляются метастазы, преимущественно в печень, часто – канцероматоз брюшины, а вот легочная ткань поражается нечасто.
Никаких специфических проявлений нет, такие же симптомы возникают при других заболеваниях желудочно-кишечного тракта. В среднем от появления первых признаков неблагополучия до выявления патологического образования проходит почти полгода.
Клиника похожа на гастрит: быстрое насыщение малыми порциями еды, чувство распирания под ложечкой, может быть эпизодическое вздутие живота. По мере увеличения узла появляется тошнота и рвота недавно съеденным. Боли нехарактерны, они отмечаются только у каждого седьмого пациента и практически никогда не бывает клинической картины «острого живота». ГИСТ не прорастает в другие органы, а оттесняет их с анатомического «законного» места.
У половины пациентов имеются признаки желудочного кровотечения: слабость, анемичность крови, эпизоды жидкого черного стула из-за изъязвления слизистой над распадающейся крупной ГИСТ.
Что характерно только для ГИСТ?
Это не клинические симптомы, а сочетание стромальной опухоли с другими новообразованиями у девочек и молодых женщин. Синдром проявляется в сочетании ГИСО с параганглиомой, как правило, на шее или в животе, и доброкачественными гамартомами легких. Называется триада Карнея, сегодня таких пациентов чуть больше сотни. Гамартомы никак себя не проявляют, их обнаруживают при рентгеновском обследовании, а гормонально активная параганглиома вызывает повышение давления. Составляющие триаду процессы появляются с интервалом в несколько лет.
Когда гастроинтестинальное стромальное образование сопровождается множественными параганглиомами, то это синдром Карнея-Стратакиса, он генетически наследуется и вызван недостатком одного фермента, опять-таки поражает женщин. От врачей зависит своевременность выявления возможных метастазов, когда они хорошо лечатся. В Европейской онкологической клинике кумулирован опыт клинического наблюдения,что помогает изменить прогноз заболевания на благоприятный.
Лечение и химиотерапия
При любой злокачественной опухоли радикально лечит только удаление, и при ГИСТ ведущий метод – хирургический. При поражении желудка выполняются резекция или удаление всего органа – гастрэктомия, всё зависит от объема поражения. Лапароскопические операции следует делать только в специализированных учреждениях, поскольку имеется опасность разрыва неплотной псевдокапсулы с выбросом опухолевых клеток в брюшную полость.
Химиотерапия иматинибом имеет хорошую перспективу при наличии мутации гена с-KIT, применяется при метастатической стадии или рецидиве после операции, перед хирургическим этапом для уменьшения размера образования и объема операции. Доза иматиниба зависит от расположения мутации гена KIT, так она увеличивается двукратно при мутации в 9 экзоне. При прогрессировании на фоне химиотерапии используют лекарства второй линии: сунитиниб и дазатиниб. Их используют и при устойчивости ГИСО к иматинибу. В качестве третьей линии лечения применяется регорафениб.
Все ГИСТ активные химиопрепараты относятся к таргетным средствам – точно нацеленным, что не исключает токсические реакции на них. Химиотерапия не обязательно должна сопровождаться плохим качеством жизни, у специалистов Европейской онкологической клиники есть возможности минимизации побочных реакций. А при метастазах ГИСО в печени в клинике выполняется методика радиочастотной аблации, которой владеют единицы российских специалистов.
Источник
Стромальный текоматоз яичников – доброкачественная гормонально-активная гиперплазия овариальной стромы, сопровождающаяся повышенным синтезом андрогенов и усиленной периферической продукцией эстрогенов. Проявляется признаками вирилизации (гирсутизмом, огрубением голоса, гипертрофией клитора), олигоменореей, аменорей, бесплодием, висцеральным ожирением. Для диагностики исследуют содержание андрогенов, эстрогенов, ЛГ, ФСГ, выполняют УЗИ органов таза, КТ, МРТ яичников, диагностическую лапароскопию с гистологическим анализом биоптата. Лечение комбинированное с резекцией или двухсторонним удалением яичников и назначением гормональных препаратов.
Общие сведения
Стромальный текоматоз (овариальный гипертекоз, стромальная гиперплазия яичников, синдром Френкеля) – редкое гинекологическое заболевание, обычно диагностируемое в перименопаузе или постменопаузе. Патологическое разрастание овариальной стромы также выявляют при гистологическом исследовании материала у 0,45% молодых пациенток, перенесших операцию на яичниках. Хотя причины возникновения текоматоза остаются неустановленными, риск развития стромальной гиперплазии возрастает при неблагоприятном преморбидном фоне (экстрагенитальной соматической, эндокринной патологии) и нарушенном становлении менструального цикла (у 67,8% больных женщин отмечалось раннее или позднее менархе). Актуальность своевременной диагностики гипертекоза обусловлена высокой вероятностью развития ассоциированных эстроген-чувствительных опухолей и первичного бесплодия, которое выявляют у 65% пациенток репродуктивного возраста.

Стромальный текоматоз яичников
Причины
Этиология синдрома Френкеля на сегодняшний день не установлена. Предположительно, превращение межуточных овариальных клеток в эпителиоидные тека-клеточные элементы с последующим формированием очагов текоматоза обусловлено сбоем гормональной регуляции у предрасположенных к заболеванию женщин. Специалисты в сфере гинекологии и эндокринологии предлагают две основные теории возникновения стромальной гиперплазии яичников:
- Наследственная предрасположенность. В части случаев овариальный гипертекоз выявляется у близких родственниц, что может свидетельствовать о его связи с дефектом X-хромосомы. Также не исключены генетические аномалии, вызывающие повышенную активность ферментов, которые отвечают за конвертацию холестерола в стероиды, в том числе андрогены, и 5α-редуктазы, трансформирующей тестостерон в его связанную форму (дигидротестостерон).
- Гипоталамо-гипофизарные нарушения. По мнению ряда авторов, стромальный текоматоз возникает из-за гиперстимуляции стромы яичников гонадотропными гормонами, в первую очередь лютеинизирующим, и связывают расстройство с нарушением регуляции менструального цикла в перименопаузе. Однако уровень ЛГ и ФСГ при гипертекозе повышен не всегда. В качестве дополнительного фактора рассматривается влияние опухолевых продуктов белкового катаболизма.
Патогенез
Ключевым звеном развития патологических расстройств при стромальном гипертекозе является гормональная активность гиперплазированных эпителиоидных тека-клеток, секретирующих половые стероидные гормоны. Капсула яичников и «дремлющие» примордиальные фолликулы в процесс не вовлечены. Текоматозные очаги не отграничены от нормальной ткани, не растут инфильтративно и не распадаются. Секреторная активность тека-клеток приводит к повышению уровня андрогенов, под влиянием которых происходит вирилизация организма, и относительной гиперэстрогении за счет периферической конверсии андростендиона в эстрон в жировой ткани. Одновременно с увеличением продукции эстрогенов повышается чувствительность к гормональной стимуляции функциональных тканей в органах-мишенях, что проявляется соответствующей симптоматикой.
Классификация
При систематизации клинических форм стромального текоматоза учитывают степень вовлеченности в патологический процесс овариальной ткани и особенности распределения секретирующих тека-клеток. Вариант гипертекоза учитывают при прогнозировании течения заболевания и выборе оптимальной схемы лечения. Различают следующие формы стромальной гиперплазии:
- Фокусная. Считается наиболее легким вариантом заболевания. Патологические изменения локализованы в части органа. Форма яичника изменена неравномерно.
- Диффузная. Наиболее распространенная форма гипертекоза. Корковый слой яичников утолщен равномерно, возможно частичное вовлечение в процесс мозгового вещества.
- Узловая. Тека-клетки объединены в узловые скопления, которые не отграничены капсулой от здоровой ткани яичников. Отдельные очаги текоматоза сливаются между собой.
Симптомы
Наиболее заметным клиническим проявлением синдрома Френкеля является вирилизация, вызванная гиперандрогенией. Женщины жалуются на появление упорной, медленно прогрессирующей угревой сыпи. Отмечаются признаки гирсутизма – избыточного оволосения по мужскому типу с ростом волос над верхней губой, на подбородке, щеках, в ареолярной области, по белой линии живота, на конечностях, спине, внутренней поверхности бедер. У пациенток со стромальной гиперплазией увеличивается клитор, снижается тембр голоса, возможно облысение мужского типа. Как правило, такие женщины по телосложению напоминают мужчин – имеют узкий таз, широкие плечи, маленькую грудь. Часто развивается висцеральное ожирение с увеличением объема живота, на коже могут появляться стрии и черный акантоз – гиперпигментация симметричных кожных складок.
На фоне увеличенного содержания андрогенов в репродуктивном возрасте нарушаются менструальная и детородная функция. Время месячных укорачивается, межменструальные промежутки удлиняются, кровянистые выделения становятся скудными. По мере прогрессирования заболевания возможно развитие вторичной аменореи с полным прекращением менструаций. Обычно женщины со стромальной овариальной гиперплазией не могут забеременеть и выносить ребенка. Относительная гиперэстрогения при текоматозе яичников более заметна в период менопаузы, постменопаузы и проявляется так называемыми признаками «омоложения» – появлением кровянистых влагалищных выделений, нагрубанием молочных желез, малой выраженностью или отсутствием инволютивных изменений слизистых оболочек репродуктивных органов.
Осложнения
Гормональный дисбаланс, возникающий при стромальном текоматозе, приводит к развитию ряда серьезных соматических заболеваний. Практически у всех пациенток выявляется инсулинонезависимый сахарный диабет с высокой инсулинорезистентностью, ожирение II-III степени. Возрастает риск возникновения артериальной гипертензии, аутоиммунного тиреоидита, диффузного токсического и пролиферирующего коллоидного зоба, гипотиреоза, интраселлярной аденомы гипофиза. На фоне повышенного содержания эстрогенов возникают рецидивирующие маточные кровотечения, чаще развиваются ассоциированные фиброзно-кистозная мастопатия и рак эндометрия.
Диагностика
Диагностический поиск при подозрении на стромальный текоматоз яичников направлен на выявление признаков секреторной активности тека-клеток и характерных морфологических изменений овариальной ткани. Осмотр и классические физикальные исследования позволяют предположить наличие гипертекоза, однако для верификации диагноза требуются данные лабораторных и инструментальных исследований. План обследования обычно включает:
- Осмотр на кресле. В ходе бимануальной пальпации определяются увеличенные безболезненные придатки тугоэластичной консистенции. При осмотре в зеркалах у пациенток в менопаузе и постменопаузе мало выражены или отсутствуют характерные признаки возрастной инволюции слизистой влагалища и экзоцервикса.
- Лабораторные анализы. Диагностически значимым критерием является повышение содержания общего тестостерона в сыворотке крови более 5,2 нмоль/л. Обычно увеличена концентрация эстрадиола и ЛГ (при нормальном уровне ФСГ). Содержание ДЭА-сульфата в крови в пределах нормы, уровень 17-КС может повышаться.
- Трансвагинальное УЗИ тазовых органов. Оба яичника обычно увеличены в размерах, имеют овальную или круглую форму. Их ткань уплотнена, выражена гиперплазия стромы. В пременопаузе фолликулы обычно смещены к периферии органа, могут отмечаться единичные кистозные изменения.
- КТ и МРТ яичников. Определяется двустороннее увеличение объема яичников в 3-8 раз, при этом овариальная строма выглядит однородной. Томографическое исследование позволяет точно оценить структуру органа и дифференцировать текоматоз от возможных объемных новообразований.
- Диагностическая лапароскопия. В ходе эндоскопического обследования можно получить биоптат для гистологического анализа. Выявление в материале лютеинизированных клеток стромы с липофильной светлой цитоплазмой служит одним из наиболее достоверных признаков заболевания.
В качестве дополнительных методов рекомендованы определение индекса инсулинорезистентности (HOMA-IR), оценка содержания гормонов щитовидной железы, гистероскопия с биопсией или раздельное диагностическое выскабливание для выявления гиперпластических процессов в эндометрии, УЗИ грудных желез, маммография. Заболевание дифференцируют с синдромом Иценко-Кушинга, адреногенитальным синдромом, поликистозом яичников, текомой, андробластомой яичника, опухолями гипофиза. К обследованию пациентки при необходимости привлекают эндокринолога, онколога, невропатолога, нейрохирурга.
Лечение стромального текоматоза яичников
Выбирая терапевтическую тактику при гипертекозе, учитывают возраст пациентки, ее репродуктивные планы, выраженность гиперплазии в эстроген-чувствительных органах-мишенях. Наиболее эффективно комбинированное лечение, сочетающее хирургический подход с патогенетической и симптоматической медикаментозной терапией. Основной целью является устранение избыточной секреции тестостерона. Оптимальными вариантами лечения считаются:
- При отсутствии репродуктивных планов: в период перименопаузы и постменопаузы обычно выполняется билатеральная овариэктомия. В качестве альтернативы пациенткам с противопоказаниями к оперативному лечению и при отказе от удаления яичников может быть предложен длительный прием агонистов гонадотропных рилизинг-факторов. Терапевтический эффект агонистов ГнРГ обычно достигается не ранее чем через 6 месяцев от начала применения.
- При наличии планов по деторождению: схема лечения аналогична терапии поликистоза яичников и включает пероральные контрацептивы, антиандрогенные препараты, агонисты ГнРГ, которые позволяют восстановить чувствительность овариальной ткани к гонадотропинам и стимулировать овуляцию. Для уменьшения признаков гирсутизма используют различные эпиляционные техники. В ряде случаев эффективна клиновидная резекция яичников.
Важным условием повышения результативности лечения стромального текоматоза является коррекция веса и применение препаратов, снижающих резистентность клеток к глюкозе. Это позволяет уменьшить риск гиперплазии и неоплазии эндометрия, миометрия, альвеолярной ткани молочных желез. Согласно наблюдениям, улучшению состояния пациенток способствует дополнительное назначение назального электрофореза витаминов В1, В6.
Прогноз и профилактика
Хотя тека-клетки не малигнизируются, а текоматоз яичников не является опасным для жизни заболеванием, он существенно ухудшает качество жизни пациентки и повышает вероятность развития злокачественных опухолей матки и молочных желез. Радикальное оперативное лечение позволяет полностью избавиться от клинических признаков заболевания. Органосохраняющие операции в комбинации с гормональной терапией обеспечивают снижение уровня андрогенов, избавление от признаков вирилизации, однако репродуктивную функцию удается восстановить лишь небольшому числу пациенток. Мероприятия первичной профилактики не разработаны. Целью вторичной профилактики является раннее выявление заболевания при плановом осмотре у гинеколога и УЗИ-скрининге. Третичная профилактика предполагает своевременное адекватное лечение, минимизирующее вероятность возникновения осложнений (рецидивирующих маточных кровотечений в постменопаузе, новообразований груди и репродуктивных органов).
Источник
