Постмастэктомический отек верхней конечности

Постмастэктомический синдром — комплекс специфических симптомов, возникающий у пациенток, перенесших радикальную мастэктомию. Проявляется отеком, изменениями кожи, неврологическими и двигательными расстройствами в руке на стороне удаленной груди, депрессией. При постановке диагноза используют результаты физикальных исследований, лимфосцинтиграфии, дуплекс-сонографии, электронейромиографии. Для лечения применяют физиотерапевтические и физические методы (пневматическую компрессию, лимфодренаж и др.), дополненные препаратами с вазоактивным и лимфодренирующим эффектом. В исключительных случаях иссекают измененные ткани, выполняют микрососудистые операции.
Общие сведения
Постмастэктомический отек верхней конечности с комплексом характерных трофических, нейромоторных и психических симптомов — одно из наиболее частых осложнений радикальных операций по поводу злокачественных неоплазий молочной железы. По наблюдениям специалистов, синдром возникает у 16,8-64,6% перенесших мастэктомию. Длительность периода между хирургическим вмешательством и временем появления клинических симптомов в среднем составляет от 10 до 24 месяцев, однако возможна и более поздняя манифестации симптоматики (через 10 и более лет). Статистически чаще расстройство поражает пациенток, у которых удалена правая грудь. Актуальность своевременного выявления патологии обусловлена существенным ухудшением качества жизни и инвалидизацией женщин на поздних стадиях заболевания.
Постмастэктомический синдром
Причины постмастэктомического синдрома
Специфический симптомокомплекс, характерный для больных, перенесших хирургическое вмешательство по поводу рака молочной железы, формируется в раннем послеоперационном и восстановительном периоде на фоне травматических повреждений, реологических и сосудистых нарушений. Выраженность расстройств связана с особенностями репарационных процессов, техникой выполнения и объемом операции, течением послеоперационного периода. Непосредственными причинами постмастэктомического синдрома являются:
- Нарушение сосудистой микроциркуляции. При радикальных методах мастэктомии удаляют подмышечный, подключичный, подлопаточный коллекторы. Это приводит к ухудшению оттока лимфы на стороне поражения. Ситуация усугубляется длительным спазмом сосудов с последующим тромбированием и воспалением (лимфангиитом, тромбофлебитом).
- Рассечение нервных волокон. Во время операции повреждаются многочисленные мелкие нервы, которые обеспечивают иннервацию сосудов и тканей в области шеи, плечевого пояса, руки. Это ухудшает восстановительные постмастэктомические процессы, вызывает болевые ощущения и специфические нарушения чувствительности, получившие название скаленус-синдрома.
- Удаление грудных мышц. Некоторые виды операций при раке молочной железы предполагают резекцию малой и большой грудных мышц на стороне опухоли. Результатом таких вмешательств становится существенное ограничение движений в плече с формированием контрактуры. Патология наблюдается практически у 40% прооперированных.
- Рубцовые изменения тканей. После удаления молочной железы, особенно в случаях, когда оно сопровождается пред- и послеоперационной радиотерапией, в области грудной клетки и подмышечной впадине происходит рубцевание. Выраженность фиброзной деформации увеличивается, если послеоперационный период протекал с гнойно-некротическими осложнениями.
По данным специалистов в сфере маммологии, частота и тяжесть постмастэктомических расстройств зависят от размеров опухоли, степени вовлечения в процесс аксиллярных лимфоузлов, наличия метастазов. Вероятность развития синдрома повышается при распространенности опухолевого процесса, неправильном определении объема операции, нарушении ее техники, неадекватной послеоперационной и лучевой химиотерапии.
Патогенез
Механизм формирования постмастэктомического синдрома основан на изменениях реологических параметров, сосудистой и перисосудистой реакции в пораженной области. Патогенез включает несколько звеньев. В сосудах на пораженной стороне повышается агрегация тромбоцитов, что приводит к спазму и микротромбозам. На фоне нарушенной микроциркуляции развивается перикапиллярный отек. Поскольку амплитуда движений руки на стороне операции ограничена, микронасосная функция скелетных мышц ухудшается. В результате кристаллоиды, белки и вода из межтканевой жидкости медленнее всасываются в микроартериолы, начинают скапливаться в виде отека. Дополнительными факторами патогенеза становятся нейротрофические нарушения и послелучевой фиброз тканей, окружающих магистральные сосуды, что вызывает сужение последних.
Классификация
Единая систематизация форм постмастэктомической патологии пока отсутствует. Большинство предложенных классификаций основано на выраженности отека тканей. При этом авторы учитывают время развития расстройств (ранние, возникшие до 3 месяцев после мастэктомии, и поздние, с отсроченным началом проявлений), плотность тканей (мягкие, твердые, деформированные), изменение объемов. При разнице между обхватом плеча, измеренным над локтем пораженной и здоровой руки, отек до 2 см расценивается как легкий, от 2 до 6 см — средний, свыше 6 см — тяжелый. Российские маммологи и онкологи часто пользуются классификацией постмастэктомического синдрома, основанной на клинических признаках:
- I степень. Отечность локализована в дистальных сегментах пораженной руки (пальцы, кисть), возникает эпизодически. Объем отекшей верхней конечности превышает объем здоровой менее чем на 25%. Снижена температура кожи кисти.
- II степень. В отек вовлечены мягкие ткани предплечья. Кожные покровы трудно захватить в складку. Увеличение объема пораженной руки составляет от 25% до 50%. Отмечается локальное понижение температуры в области кисти и предплечья.
- III степень. Отечность поднимается на плечо и держится постоянно. Ткани плотные, кожа и подкожная клетчатка фиброзно изменены, склерозированы. Кожа не берется в складку. Объем увеличен на 50-70%. Температура кожи снижена в области предплечья и кисти.
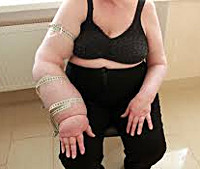
- IV степень. Рука деформирована, движения ограничены. Выявляются трофические поражения кожных покровов. Объем пораженной конечности увеличен на 70% и больше. Регистрируется снижение температуры не только на кисти и предплечье, но и на плече.
Существует также комплексная классификация, предложенная отечественными учеными. Она максимально учитывает выраженность отека, время его появления, постоянство, этапность развития, наличие эстетических нарушений, сопутствующей патологии и осложнений, их влияние на привычный образ жизни прооперированной женщины. На основании этих критериев различают следующие стадии постмастэктомического симптомокомплекса:
- Доклиническая стадия. Внешние проявления отечности отсутствуют на протяжении всего дня. Увеличение объема поврежденной верхней конечности не превышает 150,0 мл. Длина окружности плеча не изменена. Субъективных жалоб нет. Цвет кожи нормальный. Кожные покровы хорошо берутся в складку.
- Начальная стадия. Непостоянный отек отдельных сегментов или всей верхней конечности возникает преимущественно к вечеру. Увеличение объема 150-300 мл, окружности плеча — 1-2 см. Пациентка жалуется на тяжесть, периодические боли. Кожа берется в более грубые складки, теряет здоровый цвет.
- Стадия умеренных нарушений. Отечность держится постоянно, не проходит после ночного сна. Пораженная рука увеличивается на 300-500 мл в объеме и на 4-6 см в обхвате плеча. Кожные покровы сложно взять в складку. Они выглядят бледными, появляется синюшный оттенок.
- Стадия выраженных нарушений. Постоянная отечность переходит в плотную фибредему. Объем конечности возрастает на 500-700 мл. Увеличение обхвата плеча — не больше 6 см. Наблюдается деформация тканей с частичной утратой функции конечности. Пациентка испытывает парестезии, боли.
- Отягощенный постмастэктомический отек. Объем верхней конечности увеличивается на 700 мл и больше, окружность плеча — более чем на 6 см. Рука фактически не функционирует, большую часть времени вынужденно подвешена на повязку. Выражены трофические расстройства.
Симптомы постмастэктомического синдрома
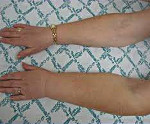
Ключевым проявлением симптомокомплекса является постепенно нарастающая отечность мягких тканей, из-за чего эта патология раньше называлась постмастэктомическим отеком (ПМО). Заболевание крайне редко развивается сразу после операции. Обычно первые признаки отечного синдрома клинически определяются спустя несколько месяцев и даже лет после вмешательства. На начальных этапах болезни к вечеру отекают дистальные сегменты верхней конечности (пальцы, кисть), пациентке трудно надеть или снять обручальное кольцо и привычные ювелирные украшения. За ночь отечность полностью проходит. В кисти может возникать ощущение тяжести. По мере развития посмастэктомического синдрома отек поднимается выше — на предплечье, плечо, надплечье, в далеко зашедших случаях он охватывает надключичную область, шею, верхнюю часть грудной клетки.
Сначала кожа над отечными участками сохраняет обычную окраску. Со временем она становится бледной, цианотичной, сухой, шелушащейся. Локальная температура снижается на 0,5-1° С. Постепенно мягкие ткани уплотняются, кожная складка формируется плохо, возможны трофические поражения. Более чем у половины пациенток с постмастэктомическими нарушениями нарушена чувствительность — возникает чувство онемения, ползания мурашек. Интенсивность болевого синдрома варьируется, женщина может ощущать как незначительную тупую, так и продолжительную тупую или кратковременную жгучую боль с иррадиацией в плечо, шею, грудную клетку. Двигательные расстройства представлены ограничением подвижности в плечевом суставе различной степени выраженности. Почти у четверти пациенток диагностируют тяжелую депрессию.
Осложнения
Длительно существующий постмастэктомический синдром может спровоцировать тендовагинит и другие поражения надостной мышцы, хронический бурсит, почти в 40% случаев ограничивающий движения рукой и приводящий к формированию контрактуры. У 1,5-11% пациенток возникают брахиоплекситы и полинейропатические расстройства. Больше чем у 99% прооперированных с такой патологией диагностируется скаленус-синдром. При отеке III-IV степени повышается вероятность рожистого воспаления. В ряде случаев хронический лимфостаз осложняется синдромом Стюарта-Тривса (возникновением лимфангиосаркомы). Поскольку посмастэктомические нарушения негативно сказываются на профессиональной пригодности женщины, их развитие сопровождается снижением самооценки, нарастанием невротической симптоматики и депрессивного синдрома.
Диагностика
При диагностике постмастэктомических нарушений в первую очередь учитывают данные физикальных исследований — оценивают объем здоровой и пораженной конечностей, их обхват над локтевым суставом, определяют кожную температуру для выявления степени ее снижения, проверяют чувствительность кожи и амплитуду движений в плече. Инструментальные методы исследования позволяют верифицировать уровень повреждения сосудистого русла, оценить функциональную состоятельность тканей. Чаще всего назначают следующие исследования:
- Лимфосцинтиграфия верхних конечностей. Радиоизотопный метод, пришедший на смену традиционной лимфографии, визуализирует особенности строения лимфатической системы, выявляет участки застоя лимфы и объективизирует снижение скорости лимфотока.
- Дуплексное сканирование. Сочетанное проведение ультразвукового и допплерографического исследования направлено на определение скорости кровотока, анатомических особенностей и проходимости артериальных и венозных сосудов.
- Электронейромиография. Методика позволяет объективно оценить функциональное состояние периферических нервов, иннервирующих кожу, мышцы и сосуды верхних конечностей, диагностировать выраженность неврологических расстройств.
В ходе комплексного обследования выполняют лабораторные анализы для оценки системы гемостаза, в сложных клинических случаях проводят МРТ, КТ. Дифференциальная диагностика заболевания, как правило, не представляет особых сложностей с учетом возникновения нарушений после мастэктомии. Несмотря на очевидность причин развития постмастэктомического синдрома, необходимо сохранять настороженность в отношении других причин лимфостаза — доброкачественных и злокачественных опухолей лимфатической системы, воспалительных сосудистых заболеваний. При необходимости к обследованию пациентки привлекают хирурга, онколога, лимфолога, флеболога, невропатолога, дерматолога, инфекциониста.
Лечение постмастэктомического синдрома
Врачебная тактика при развитии отека, неврологических и двигательных расстройств после мастэктомии направлена на восстановление нарушенных функций — облегчение лимфодренажа, разработку плечевого сустава, нейростимуляцию. Ведущей является комплексная консервативная терапия, которая лишь в крайних случаях дополняется хирургическими методиками. Пациенткам с постмастэктомической болезнью назначают:
- Физические и физиотерапевтические воздействия. Наиболее эффективны аппаратная пневматическая компрессия руки от пальцев и кисти до надплечья, ручной и механический лимфодренаж. Эти методики дополняют специальными физическими упражнениями, ношением бандажей, многослойных неэластичных и эластических повязок. Предварительное применение ультразвука позволяет «размягчить» ткани, уменьшить остеомиофасциальные боли, улучшить чувствительность и подвижность в суставах. Некоторые специалисты получили хорошие терапевтические результаты при использовании световой и низкоуровневой лазеротерапии, электромиостимуляции.
- Медикаментозное лечение. Из фармакологических средств при послемастэктомическом синдроме часто назначают бензопироны — препараты с вазоактивным, антиэдематозным и противовоспалительным эффектом. Для усиления их действия применяют ангиопротекторы, капилляростабилизаторы, антиагреганты, витамины с антиоксидантным действием. Хороший эффект в купировании болевого синдрома и коррекции нейродвигательной патологии достигается при введении психоаналептиков и протеолитических ферментов. При выраженной боли и эмоциональных расстройствах допустимо использование седативных и нестероидных противовоспалительных средств.
- Хирургические методы. Оперативный подход к устранению постмастэктомического лимфостаза практикуется редко. В ходе хирургической коррекции иссекается рубцовая ткань с замещением дефекта собственной кожей или кожно-мышечным лоскутом пациентки. Микрососудистые техники позволяют сформировать лимфовенозные анастомозы, освободить от сращений подключичную и подмышечную вены. Возможности хирургического лечения у больных с нарушениями после мастэктомии ограничены многостадийностью, травматичностью, сложностью технического исполнения, достижения стойких функциональных и косметических результатов.
Прогноз и профилактика
Несмотря на высокую терапевтическую резистентность расстройства, комплексный подход и своевременное начало лечения на ранних стадиях постмастэктомического синдрома позволяют уменьшить выраженность отека и улучшить функциональные возможности пораженной руки. С профилактической целью необходимо обоснованно определять вид и объем вмешательства при злокачественном новообразовании груди, тщательно соблюдать технику выполнения операции. В конце первой недели послеоперационного периода показаны дозированные упражнения для разработки плечевого сустава, с 3 недели — самомассаж мышц и кожи. В последующем женщине рекомендуются умеренные физические нагрузки, исключение сдавливаний руки, ее защита от возможной травматизации на производстве или в быту.
Источник
Комментарии
М.О. Мясникова
Кафедра хирургии СПбГМУ им. академика И.П.Павлова, Санкт-Петербург
Постмастэктомический отек конечности (ПМОК) является составной частью так называемого постмастэктомического синдрома, комплекса функциональных и косметических нарушений, возникающих в результате радикального хирургического лечения рака молочной железы (РМЖ).
Несмотря на успехи современной онкологии, внедрение в клиническую практику новейших средств диагностики и лечения, РМЖ сохраняет лидирующее положение среди всех злокачественных опухолей у женщин. К 2010 г. прогнозируется рост заболевания до 1,45 млн человек [1]. В России ежедневно РМЖ заболевает 106 женщин [2]. Так, в 2001 г. в России зарегистрировано 45 257 пациенток со злокачественными новообразованиями молочных желез.
По разным статистическим данным, независимо от выбранных методов лечения, у 10-80% больных РМЖ после курса терапии разовьется ПМОК [3-9]. Значительно ухудшающий качество жизни пациентов, более 90?ь из которых находятся в трудоспособном возрасте, ПМОК является не только медицинской, но и социально-экономической проблемой.
Причины его возникновения связаны с особенностью всех радикальных операций на молочной железе, выполняющихся с обязательной подмышечной лимфодиссекцией, при которой неизбежно пересекаются коллекторные лимфатические сосуды, осуществляющие лимфатический отток от верхней конечности.
Появлению ПМОК в ряде случаев может способствовать также лучевая терапия, вызывающая фиброзные дегенеративные изменения в мягких тканях конечности, приводящие к нарушению лимфотока. Длительный застой лимфы, являющейся благоприятной питательной средой для бактериальных агентов, создает условия для развития рожистого воспаления. Последнее в свою очередь ухудшает лимфообращение конечности и приводит к развитию грубых Рубцовых изменений кожи, подкожной клетчатки и фасции. Прогрессирование заболевания приводит к обезображиванию конечности и развитию “слоновости”.
Дополнительными факторами, влияющими на частоту развития ПМОК, являются индивидуальные особенности больных с РМЖ. При этом важнейшей из них следует считать индивидуальную вариантную характеристику лимфотока конечности. По нашим данным, примерно 20% людей обладают врожденными анатомическими компенсаторными механизмами, позволяющими сохранить достаточный лимфатический дренаж конечности даже после пересечения коллекторных лимфатических сосудов. Этому способствуют так называемые вставочные лимфатические узлы, не функционирующие в норме. Эта группа пациентов обычно переносит лечение РМЖ без формирования ПМОК. У остальных пациентов развитие ПМОК прогнозируемо. У 20% больных процесс развивается особенно быстро и носит выраженный фиброзный характер. Как правило, это пациенты с диффузным типом лимфотока, у которых отсутствуют хорошо выраженные коллекторные лимфатические сосуды.
Таким образом, ранняя диагностика нарушений лимфотока верхней конечности и раннее начало его лечения являются принципиальным для каждой второй пациентки, перенесшей радикальное противоопухолевое лечение РМЖ.
Клиническое обследование больных с ПМОК традиционно начинается с определения степени увеличения объема конечности. При этом тяжесть процесса ранее, как правило, определяли по величине окружности руки, измеренной на стандартных уровнях. Однако имеющийся опыт свидетельствует о том, что подобный подход не позволяет сделать правильный тактический выбор, так как значительные размеры отека не всегда отражают далеко зашедший процесс. В связи с этим в течение 18 лет мы пользуемся клинико-хирургической классификацией ПМОК, учитывающей степень напряжения и гидрофильность мягких тканей конечности, а также наличие или отсутствие стеноза подключичной вены и венозной гипертензии. Выделенные нами стадии “доклиническая”, “преходящего”, “мягкого”, “плотного” и “деформирующего” отека легко определяются клинически и, по нашему мнению, обусловливают тактику лечения.
Клиническое обследование дополняется специальными методами исследования, важнейшими из которых являются динамическая лимфосцинтиграфия, позволяющая получить прижизненное контрастирование функционально полноценных лимфатических сосудов и узлов, флеботонометрия (измерение интравенозного давления в поверхностных венах конечности), а также флебография, ультразвуковое исследование мягких тканей конечности и в ряде случаев компьютерная томография.
Лечение ПМОК остается довольно сложной задачей. Наличие многих методов, используемых для коррекции объема конечности, свидетельствует об отсутствии единого подхода к этой проблеме, а конечные результаты лечения не всегда удовлетворяют.
Важное место при лечении ПМОК играет консервативная терапия, которая может использоваться как самостоятельный метод лечения или дополнять оперативное вмешательство. Ее цель, учитывая особенности патогенеза отека верхней конечности, – повышение тонуса и мышечной активности лимфатических сосудов, раскрытие не функционирующих в норме лимфовенозных (ЛВА) и лимфо-лимфатических анастомозов и формирование коллатеральных путей лимфотока. Следует отметить, что важным условием успешного консервативного лечения является формирование у больных с отеком конечности правильных психологических установок, ориентирующих пациенток на продолжительное лечение с постоянно повторяющимися курсами, а также на правильную оценку его результатов. Неоправданное ожидание быстрого эффекта от любого из применяемых методов лечения ПМОК может привести к полному отказу больной от его продолжения и значительному ухудшению косметического и функционального состояния конечности.
Как самостоятельный метод лечения консервативная терапия показана прежде всего больным с начальными проявлениями ПМОК (в доклинической и I стадии заболевания), особенно у пациенток с прогностически неблагоприятным диффузным типом лимфотока конечности (по данным лимфосцинтиграфии). Во II и III стадиях заболевания ее можно использовать в качестве альтернативного хирургическому вмешательству метода, если выполнение лимфодренирующей операции невозможно (отсутствие коллекторных лимфатических сосудов, дистальный уровень блока лимфотока) или пациентка отказывается от ее проведения. У больных с выраженными фиброзными изменениями кожи и подкожной клетчатки консервативное лечение в качестве монотерапии показано для стабилизации или улучшения функционального состояния конечности.
При сочетании с хирургическими методами лечения комплексную консервативную терапию можно применять в до- и послеоперационном периоде. При этом ее используют в качестве предоперационной подготовки, так как это способствует успешной послеоперационной реабилитации больных.
Задачами консервативной терапии при лечении ПМОК являются:
- стимуляция сократительной способности мышечных элементов стенки лимфатических коллекторов,
- механическое вытеснение застойной лимфы из мягких тканей конечности,
- улучшение реологических свойств лимфы и крови, а также метаболизма отечных тканей конечности,
- противовоспалительное действие.
Ее основными патогенетически обоснованными методами являются компрессионное лечение (чередующаяся пневматическая компрессия и эластическая компрессия с помощью специальных бинтов и лечебного трикотажа) и фармакотерапия.
Мы использовали два метода компрессионной терапии: 1) чередующуюся пневмокомпрессию, 2) лечение компрессионными бинтами и компрессионным трикотажем.
Чередующаяся пневмокомпрессия. Чередующуюся пневмокомпрессию выполняли больным с помощью отечественного аппарата “АПКУ-5”. Перед процедурой проводили кратковременный (10-15 мин) ручной массаж конечности приемами поглаживания и легкого растягивания. Воздействие проводили в режиме “нарастающей волны”, характеризующемся последовательным нагнетанием воздуха в секции манжет в направлении от дистальных отделов конечности к проксимальным. Рабочее давление составило 40-60 мм рт. ст., а в первые 2-3 процедуры в послеоперационном периоде – 30-40 мм рт. ст. Время нагнетания воздуха в каждую секцию составило 15-20 с, пауза – 10-15 с. Средняя продолжительность процедуры – 30-40 мин. После процедуры проводили кратковременное (5-10 мин) занятие гимнастикой, сжатие и разжатие кулака, медленное сильное сгибание и разгибание запястья, подъем руки вверх и отведение ее за голову.
Курс лечения определяли индивидуально для каждой больной (обычно от 10 до 14 процедур).
Дозированную чередующуюся пневмокомпрессию назначали 240 больным, в том числе 90 в разных сочетаниях с микрохирургическими и резекционными операциями. Накопленный опыт убедил нас в необходимости дифференцированного подхода к этим сочетаниям. Оказалось, что пневмокомпрессия наиболее эффективна в послеоперационном периоде наложения JIBA, а ее использование в виде предоперационного курса несколько ухудшает гемодинамические условия, в которых оказывается вновь сформированный ЛВА (см. таблицу).
Результаты сочетания микрохирургического наложения ЛВА и пневматической компрессии верхней конечности
| Метод лечения | Хороший результат | Удовлетворительный результат | Плохой результат | Всего | ||||
|---|---|---|---|---|---|---|---|---|
| абс. | % | абс. | % | абс. | % | абс. | % | |
| Пневматическая компрессия и ЛВА | 9 | 30 | 17 | 56,7 | 4 | 13,3 | 30 | 100 |
| ЛВА и пневматическая компрессия | 12 | 40 | 17 | 56,7 | 1 | 3,3 | 30 | 100 |
| ЛВА | 11 | 36,7 | 17 | 56,7 | 2 | 6,6 | 30 | 100 |
Компрессионные бинты и компрессионный трикотаж. Этот вид лечения традиционно применяют практически при лечении всех больных с постмастэктомической лимфедемой. Бинтование конечности эластичными бинтами производится ежедневно. Уровень наложения компрессионного бандажа и продолжительность лечения определяют индивидуально в каждом конкретном случае.
Медикаментозная терапия является обязательной составной частью консервативной терапии ПМОК и включает несколько групп препаратов. Основными из них являются лекарственные средства, стимулирующие лимфодренажную функцию конечности и воздействующие одновременно на венозный тонус, улучшая лимфатический отток. Кроме того, по показаниям используют антибиотики, десенсибилизирующие препараты, иммуномодуляторы.
В течение продолжительного времени препаратами выбора группы лимфотоников являются медикаментозные средства на основе биофлавоноида диосмина, обладающего поливалентным действием, что определяет высокую эффективность препарата при лимфатических отеках конечности.
Потенцируя физиологический эффект норадреналина, диосмин способствует повышению частоты и амплитуды перистальтики лимфатических сосудов, повышает онкотическое давление лимфы и способствует усилению лимфотока, в целом снижает проницаемость капилляров и оказывает прямое защитное действие на микроциркуляторное русло, и, кроме того, обладает выраженным противовоспалительным эффектом, блокируя синтез медиаторов воспаления (простагландины PGE-2, PGE-2a, тромбоксан В2) и снижает вязкость крови.
В настоящее время круг флеботоников на основе диосмина расширяется. В России появился новый оригинальный препарат Флебодиа 600 (“Лаборатория Иннотек Интернасиональ” Франция), ангиопротектор, содержащий гранулированный высокоочищенный диосмин. Фармакологические свойства препарата практически соответствуют свойствам диосмина. В то же время его применение, как показывает клиническая практика, более удобно для пациентов, так как суточная потребность ограничивается 1 таблеткой. Это же обстоятельство делает препарат более экономичным (его курсовая стоимость ниже таковой других венотоников).
В течение 2 лет мы применяем препарат Флебодиа 600 для лечения пациенток с ПМОК в I и II стадии заболевания (по 1 таблетке 1 раз в сутки в течение 2 мес). Период наблюдения в среднем составляет 12 мес. Получены хорошие клинические результаты: уменьшение отека, улучшение функции конечности. Побочных действий не зарегистрировано.
Большое значение в комплексной консервативной терапии играет профилактика рецидивирующего рожистого воспален™. В этом отношении незаменима антибактериальная, десенсибилизирующая и иммунокорригирующая терапия, которую проводят циклами 1-2 раза в год.
Таким образом, комплексная консервативная терапия является важнейшей составной частью лечения постмастэктомической лимфедемы конечности. Она позволяет добиться хороших результатов у больных с ранними формами ПМОК и является необходимым дополнением к хирургическому лечению.
Литература
- Parkin D, Pisani Р, Ferley J et al. Global cancer statistics. CA Cancer J Clin 1999; 49:33-642. Возный ЭК, Добровольская НЮ., Гончарова ИМ. Лечение метастазов рака молочной железы в печень без использования препаратов таксанового ряда.Вопр. онкал. 1999; 45 (2): 189-91.
- Егоров Ю.С. Современные аспекты хирургического лечения постмастэктомического синдрома. Автореф. дис.. д-ра. мед. наук.М, 2000.
- Мельников РА., Шабаиюва НЯ., Семиглазов В.Ф. и др. О медицинской реабилитации больныхракам молочной железы. Вопр. онкал. 1981; 7: 77-82.
- Пронин ВИ„ Розанов ЮЛ., ВельшерЛЗ. Мастэктомия и ее последствия. М.: Медицина, 1985.
- РамоноваЛЛ. Ранние осложнения радикальной мастэктомии и их предупреждение. Автореф. … дис. _ канд.мед. наук.М, 1991.
- ШпехтЛЕ. Условия возникновения отека верхней конечности после мастэктомии. Современные проблемы онкологии.Л.: Медицина, 1966; 94-102.
- Casley -Smith Judith Casley-Smith JRR. Lymphaticovenous insufficiency and its conservative treatment. Phlebolympholog> 1995; 6:9-13.
- GoltnerE, Gass P, HassJP. The impotance ofvolumetry, lymphoscintigraphy and computer tomography in the diagnosis of brachial edema after mastectomy. Lymphology 1988; 21: 134-4310. Petrek JA, Senie RT, Peters M, Rosen PP. Lymphedema in a cohort of breast carcinoma survivors 20years after diagnosis. Cancer2001; 92 (6): 1368-77
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
