Перифокальный отек в мозжечке
ГЛАВА 19 ОТЕК МОЗГА
19.1. ОБЩИЕ ПОЛОЖЕНИЯ
Отек
головного мозга (oedema cerebri) – патологический процесс,
характеризующийся накоплением воды в головном мозге, увеличением его
массы и объема. Вода может накапливаться как в межклеточных
пространствах, так и внутри клеток. Нередко отек мозга сначала имеет
ограниченный характер, а в последующем распространяется на все более
обширные территории мозга. Обычно отек ведет к повышению
внутричерепного давления.
Патофизиологическим
фактором, способствующим развитию отека мозга, является гипоксия. Она
влечет за собой своеобразный каскад патофизиологических явлений:
увеличение парциального давления углекислого газа в крови (РаСО2)
=> тканевый ацидоз => начинающийся отек мозговой ткани =>
замедление артериального кровотока => нарушение ликвороциркуляции
=> затруднение венозного оттока из полости черепа => нарастание
выраженности отека мозга, при этом, как правило, возникает
дезорганизация функций гематоэнцефалического барьера (ГЭБ), изменение
мембранного потенциала клеток мозга, нарушение транспорта ионов через
клеточные мембраны, их патологическое накопление и избыточное
количество жидкости во внеклеточных и внутриклеточных пространствах.
Раньше
внутриклеточное накопление воды признавалось набуханием, отеком же
считалось лишь увеличение количества воды в межклеточных пространствах.
Однако эти процессы проходят обычно параллельно и их дифференциация в
связи с этим не оправдывается. Потому все процессы накопления воды в
мозге стали именоваться его отеком, хотя некоторые авторы предпочитают
говорить об отеке-набухании. Также существует мнение, что термином
«набухание мозга» следует обозначать гиперемию мозговой ткани (Потапов
А.А., Гайтур Э.И., 1998), возникающую, в частности, при его
травматическом по- ражении.
19.2. ВАРИАНТЫ ОТЕКА МОЗГА
Отек головного мозга всегда ведет к увеличению его объема и массы и, как следствие, к повышению внутричерепного давления. Значима
не только распространенность отека, но и его локализация. Повышенную
опасность для больного имеет отек медиобазальных отделов височной доли,
часто приводящий к вклинению ее ткани в вырезку намета мозжечка (в
тенториальное отверстие),
отек мозжечка, рано вызывающий блокаду ликворных путей и развитие окклюзионной гидроцефалии, а также отек ствола мозга.
Возможны различные причины отека мозга: травма
мозга, нарушение мозгово- го кровообращения, в частности
гипертонический криз, острая гипертоническая энцефалопатия,
геморрагический инсульт, инфаркты, а также опухоли мозга, эн- цефалиты
или менингоэнцефалиты, гипоксическая или токсическая (эндогенная или
экзогенная) энцефалопатия, облучение мозга, эпилептический статус.
В
патогенезе отека мозга преобладающими могут быть сосудистые
(вазогенные), тканевые (интерстициальные) факторы, цитотоксические
(дисметаболические) и осмотические процессы. Они отличаются друг от
друга особенностями биохимических и патофизиологических механизмов
развития и распределения в мозговой ткани отечной жидкости. Преобладание
проявлений той или иной формы отека мозга зависит от многих
обстоятельств, в частности от характера обусловившего его
патологического процесса и возраста больного.
В основе вазогенного отека лежит
значительное повышение давления в капиллярах мозга, расширение в них
межэндотелиальных щелей, при этом увеличивается перфузионное давление в
сосудах мозговой ткани, повышается проницаемость ГЭБ, происходит выход
коллоидных компонентов плазмы во внеклеточную жидкость, что
способствует усилению фильтрации в межклеточные пространства мозга
воды, которая в значительном количестве скапливается в белом веществе. Вазогенный отек развивается при острых нарушениях мозгового кровообращения, энцефалите, незрелой глиальной опухоли.
Интерстициальный отек мозга является
также формой межклеточного отека, обусловленного прежде всего
нарушением ликвороциркуляции, особенно выраженным при окклюзионной
гидроцефалии. Жидкость проникает через выстилающий желудочки
мозга слой эпендимных клеток (эпендимоциты) в паравентрикулярно
расположенные структуры белого вещества мозга.
Цитотоксический (дисметаболический) отек мозга обусловлен повреждающими мозг экзогенными и эндогенными факторами и нарушением в нем метаболических процессов, проявляется
расстройством функции энергозависимых мембранных натрий-калиевых
ионных насосов и деполяризацией клеточных мембран, наступающей при
снижении уровня мозгового кровотока. Деполяризация мембран ведет к
электролитному дисбалансу, повышению осмотического давления в
клеточных элементах мозговой ткани и накоплению в них жидкости.
Осмотический отек развивается в
результате патологичных изменений осмотического градиента между
плазмой крови и жидкости в межклеточных про- странствах мозговой ткани,
особенно выражен при остром поражении мозга у детей,
развивается также при чрезмерно ускоренном гемодиализе у больных с
уремией на фоне острой или хронической почечной недостаточности и прояв- ляется как в белом, так и сером веществе мозга. В
эксперименте на обезьянах доказано, что при осмотическом отеке в мозге
изменяется количество таких ферментов, как лактатдегидрогеназа,
креатинфосфокиназа, усиливается анаэ- робный гликолиз, возрастает
количество молочной кислоты.
По распространенности различают локальный, трифокальный, долевой полушарный и диффузный отек мозга. Возникающая
при отеке мозга клиническая картина обусловлена дисфункцией
подвергшейся отеку мозговой ткани, расстройством в ней микроциркуляции,
метаболических процессов и возникающим при этом увеличением объема
мозговой ткани, которое может сопровождаться смещением, а иногда и
вклинением определенных мозговых структур, нарушениями кровотока в
сосудах мозга и ликвородинамики.
При выраженном
отеке мозга обычно возникает сочетание всех проявлений, характерных для
отмеченных вариантов. В отечной ткани оказывается выраженным снижение
артериовенозной разницы по кислороду, снижается потребление кислорода
клеточными структурами, нарастает накопление продуктов нарушенного метаболизма.
Для клинической картины выраженного отека мозга характерны общемозговые симптомы (снижение уровня психической активности, загруженность, диффузная головная боль), которые могут сочетаться с появлением или нарастанием очаговых неврологических симптомов, выраженность которых резко увеличивается в случаях смещения и вклинения отечных мозговых структур.
На
КТ и МРТ отечная ткань мозга характеризуется пониженной плотностью. По
результатам повторных КТ- и МРТ-исследований можно следить за
изменениями объема мозговой ткани и выявляемой в ней зоны отека, за
сопутствующими деформациями мозговых структур и изменением формы и
размера желудочков мозга и таким образом контролировать в динамике
выраженность отека. На основании КТ- и МРТ-исследований установлено,
что при распространении отека на глубинные структуры мозга вектор
клиренса отечной жидкости направлен в сторону ближайшей стенки
желудочковой системы мозга. Об этом свидетельствует нередкое выявление
на КТ гиподенсивной дорожки от зоны перифокального отека к прилежащим
отделам желудочковой системы.
При
макроскопическом осмотре отечного мозга обращает на себя внимание
увеличение его объема и влажности, на разрезе – нечеткость границ между
серым и белым веществом. Гистологическое исследование позволяет
выявить расширение межклеточных и околососудистых щелей, изменения
эндотелия капилляров, увеличение объема нейронов и особенно глиальных
клеток (астроцитов и олигодендроцитов), утолщение нервных волокон,
нарушение струк- туры миелиновой оболочки.
19.3. ЛЕЧЕНИЕ
При
появлении признаков отека мозга необходимо выявление его причины, что
может быть достигнуто уточнением клинического диагноза. Желательно, конечно, чтобы причина отека мозга была устранена, что иногда можно достичь проведением соответствующего этиологического и патогенетического консервативного лечения, например при гипертоническом кризе, контузии головного мозга, энцефалите, или хирургического вмешательства: удаление
гематомы, абсцесса, опухоли, а при черепно-мозговой травме – отломков
кости, инородных тел, подоболочечной или эпидуральной гематомы.
Во
всех случаях отека мозга, сопровождающегося внутричерепной
гипертензией, показано медикаментозное лечение, направленное на
дегидратацию мозговой ткани. С этой целью применяются осмотические
диуретики, салуретики и кортикостероиды. Различные в
каждом конкретном случае патогенетические особенности, темп развития
отека мозга и степень его выраженности не позво- ляют рекомендовать
жестких стандартных схем применения препаратов, ока- зывающих
противоотечное действие.
Показаниями к назначению осмотических диуретиков являются признаки выраженного отека мозга, остро возникающее или прогрессирующее повы-
шение
внутричерепного давления, сопровождающееся нарастающей общемозговой и
очаговой неврологической симптоматикой, смещением мозговых структур,
угрозой вклинения мозговой ткани, а также подготовка к экстренной
нейрохирургической операции.
Из осмотических диуретиков чаще применяется маннитол (15%
раствор внутривенно капельно в течение 10-20 мин из расчета 0,5-1,5
г/кг массы тела больного, повторяя введение препарата в той же дозе
через каждые 6 ч) или глицерол (0,5-1,0 г/кг внутрь,
можно в смеси с сиропом, при необходимости – через назогастральный
зонд). В процессе лечения осмолярность крови должна поддерживаться на
уровне не выше 300-310 мосм/л. Действие маннитола проявляется через 10-20 мин и продолжается 4-6 ч. Вводят маннитол или содержащий его комбинированный препарат реоглюман (внутривенно
капельно сначала по 5-10 капель, а затем 30 капель в 1 мин);
рекомендуется сделать перерыв через 2-3 мин и при отсутствии побочных
явлений продолжать введение препарата со скоростью до 40 капель/мин,
при этом вводится 200-400 мл). Эти препараты дают выраженный
дегидрирующий эффект, понижают агрегацию форменных элементов крови,
уменьшают вязкость крови и способствуют восстановлению кровотока в
капиллярах, увеличению оксигенации ткани. Суточная доза маннитола не должна превышать 140-180 г.
Надо иметь в виду проявляющиеся при введении маннитола и других осмотических диуретиков нежелательные побочные явления: 1)
вследствие увеличения при введении осмотических диуретиков объема
циркулирующей в сосудах крови возможны нарастание сердечной
недостаточности и отек легких; 2) дегидратация, обусловленная
стимуляцией диуреза, сопровождается проявлениями гипокалиемии; 3) по
окончании действия маннитола в случае повреждения ГЭБ может проявляться эффект отдачи – вновь
наступающее нарастание отека мозга в связи с возвращением воды из
плазмы крови в ткани. К тому же осмотические диуретики обеспечивают
дегидратацию и уменьшение общего объема мозговой ткани, воздействуя
главным образом на непораженные структуры мозга. Это делает
целесообразным применение его прежде всего при явных признаках
сдавления мозга. Показатели осмотичности крови выше 300 мосм/л и
диурез, превышающий 4-6 л в сут, надо рассматривать как осно- вания для
ограничения дальнейшего применения осмотических диуретиков.
Эффективность
глицерола ниже, чем маннитола: он начинает действовать через 12 ч
после приема внутрь, но практически не вызывает феномена отдачи. Эффективность
приема глицерола отмечается лишь у больных с нерезко вы- раженным
отеком головного мозга, главным образом при ишемическом инсульте.
С целью дегидратации при отеке мозга применяют также салуретики из группы петлевых диуретиков, чаще – фуросемид (лазикс), обычно
по 20-40 мг внутримышечно или внутривенно до 3 раз в день, иногда
целесообразно их сочетание с осмотическими диуретиками (вводят через
3-4 ч после введения маннитола). Фуросемид начинает действовать через
35-105 мин, длительность действия 30 мин-2,5 ч. Показания к назначению петлевых диуретиков: 1)
желательность усиления эффекта, вызываемого осмотическим диуретиком;
2) выравнивание водного баланса в случае выраженного накопления
жидкости в организме; 3) дегидратация при нерезко выраженном отеке
мозга.
Петлевые
диуретики, как и осмотические, также в большей степени воздействуют на
неповрежденные отделы мозга, поэтому профилактическое назначение их при
острых неврологических заболеваниях может оказаться бес-
полезным или даже вредным, так как вызывает нарушение электролитного баланса (снижение содержания калия в крови).
Диакарб (фонурит, ацетазоламид) – это салуретик из группы ингибиторов карбоангидразы, может
применяться вместо фуросемида при явлениях умеренного отека мозга по
250 мг внутрь или через зонд 2-4 раза в день, при этом необходим
контроль за содержанием калия в крови. Начало действия диакарба через 40-120 мин, длительность действия 3-8 ч. В связи с тем, что диакарб подавляет продукцию ЦСЖ, его применение можно признать особенно целесо- образным при интерстициальном варианте отека мозговой ткани.
Кортикостероиды
уменьшают проницаемость ГЭБ, способствуют нормализации проницаемости
мембран и микроциркуляции, блокируют синтез простагландинов и других
веществ, способствующих формированию отека при воспалительных, в
частности инфекционных, процессах, а также и при опухолях мозга. При наличии показаний к применению кортикостероидов обычно назначают дексаметазон в дозе 12-16 мг, в тяжелых случаях 24-48 мг в сут. Начальную его дозу (1/4
суточной) вводят внутривенно, капельно. Повторно препарат назначается
внутривенно или внутримышечно через каждые 6 ч. В очень тяжелых случаях
вводится до 60-100 мг дексаметазона в сутки с постепенным уменьшением
дозы препарата.
При назначении преднизолона следует
учитывать, что его действие более кратковременно, чем дексаметазона;
расчет необходимых доз преднизолона должен производиться исходя из
того, что его терапевтическая активность в сравнении с дексаметазоном в 7 раз меньше. Противопоказанием к назначению кортикостероидов может быть выраженное повышение АД.
При введении больших доз кортикостероидов показано раннее назначение антацидных средств (альмагель
по 2 чайные ложки 4 раза в день или окись магния в порошке по столовой
ложке 4 раза в день и др.) за 15-30 мин до приема пищи естественным
путем или до введения питательной смеси через назогас- тральный зонд.
Применение антацидов направлено на предотвращение желудочных
кровотечений и развития синдрома Мендельсона (абсцедирующая пневмония
вследствие аспирации желудочного сока, если его рН <2).
При длительном применении кортикостероидов возможен ряд побочных явлений и осложнений: замедление
заживления ран, провокация обострения имеющихся инфекционных очагов,
депрессия и психозы, пептические язвы, субкапсулярная катаракта,
остеопороз, признаки синдрома Кушинга. Частота побочных явлений зависит
от характера препарата, его дозы, продолжительности лечения; в целом
она довольно велика и проявляется примерно в 50% случаев при лечении
кортикостероидами. Строго ограничены показания к применению кортикостероидов при гнойном менингите. Их
следует применять лишь при выраженном отеке мозга обычно в качестве
дополнения к внутривенным введениям маннитола (Хартер Д.Х., Петерсдорф
Р.Г., 1997).
Противоотечное действие кортикостероидов обычно проявляется через 12 ч. Кортикостероиды
особенно действенны при вазогенном отеке, обусловленном опухолью
мозга, эффективность их при черепно-мозговой травме, особенно у
взрослых, при кровоизлиянии в мозг, а также при цитотоксическом отеке,
связанном с гипоксией и ишемией мозга, является спорной.
При
лечении кортикостероидами требуется регулярный контроль за содержанием
глюкозы и электролитов в крови для своевременной диагностики иногда
возникающих гипергликемии и гипернатриемии. Возможна целесообразность
параллельного введения антигистаминных препаратов и в некоторых случаях
(для профилактики инфекционных осложнений) антибиотиков.
Больным с отеком мозга, наряду с дегидратацией, необходим
контроль за уровнем вентиляции легких и состоянием центральной
гемодинамики, а также принятие мер по нормализации микроциркуляции и
общего мозгового кровотока.
При отеке мозга больные могут нуждаться в неспецифическом лечении, направленном на нормализацию дыхания (восстановление
проходимости дыхательных путей, обеспечение достаточной оксигенации,
предупреждение и своевременное лечение легочных осложнений), сердечной деятельности, артериального давления. Для облегчения венозного оттока из полости черепа следует приподнять головной конец кровати и установить под углом 15-30?. Необходимы
контроль за состоянием водно-электролитного баланса, КОС и их
коррекция, при этом желательно ограничить количество вводимой жидкости
до 1,5-2 л в сут.
По возможности стоит избегать применения сосудорасширяющих средств:
нитроглицерина,
амиодарона (кордарон), дибазола, антагонистов ионов кальция:
нифедипина (фенигидин, адалат, коринфар, кордипин), а также резерпина,
аминазина, дроперидола, особенно в больших дозах. Проводя дегидратацию,
необходимо одновременно купировать чрезмерную артериальную
гипертензию, проводить соответствующие меры в случае гипертермии,
психомоторного возбуждения, эпилептических припадков. По показаниям
применяют антигипоксанты, метаболически активные средства, в частности
ноотропы, витаминные комплексы.
Клинические проявления и лечебные мероприятия при высоком внутричерепном давлении описаны также в главах 20, 21.
Источник
Соавтор: Сотников В. В., к.в.н., главный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Для выбора оптимальной лечебной тактики и планирования нейрохирургического вмешательства при опухолях головного мозга важно получить наиболее полную диагностическую информацию не только о локализации и гистологических свойствах опухоли, но и о выраженности и характере перифокальных реакций мозга, существенно влияющих на клинические проявления заболевания. Значительный перифокальный отек снижает выживаемость пациентов при менингиомах (Motta L, Mandara MT, Skerritt GC.2012).
Наиболее общей, закономерно развивающейся реакцией при очаговых поражениях (прежде всего при опухолях мозга) является перифокальный отек, в основе развития которого лежит взаимодействие сосудистого и паренхиматозного фактора.
Принято различать вазогенный и цитотоксический отеки мозга, которые могут сочетаться и изменять количественные соотношения в динамике развития в зависимости от вызвавшей их причины. Перифокальный отек при опухолях мозга формируется за счет увеличения объема внеклеточного пространства в результате накопления в нем жидкости, поступающей из поврежденных глиальных клеток, и вследствие повышения проницаемости клеточной мембраны эндотелия капилляров в зоне, окружающей очаг поражения. Распространенность зоны перифокального отека определяется не только увеличением содержания в ней воды, но и степенью регионарной демиелинизации волокон белого вещества мозга.
Чем выше степень демиелинизации, тем меньше содержание липидов в перифокальной зоне и тем более выражены нарушения процессов окисления и фосфорилирования, а также явления отека мозга (Chan Р.Н., Fishmann R.A. 1978). В прогрессировании перифокального отека основную роль играют два механизма: поступление в белое вещество мозга белков плазмы и их связывание с глиальными элементами; увеличение дальнейшего поступления жидкости в перивазальное пространство вследствие осмотического градиента; а также, по аналогичному механизму, поступление жидкости из ликворной системы (Priden F.R., Tsayumu M., Reulen H.J. 1979; S.Reulen H.J., Graber S., Huber P., Jto U. 1988).
Многочисленные исследования в гуманной медицине, проведенные в Институте нейрохирургии АМН Украины, свидетельствуют о существовании динамических различий между явлениями отека и набухания мозга. Отек — это увеличение содержания свободной воды в межклеточных интерстициальных пространствах, а набухание — это накопление свободной воды в клетках и связанной воды в межклеточных пространствах. Для внутримозговых опухолей, особенно для глиом, характерно преобладание отека в перифокальной зоне (О.Ю.Чувашова 2000).
По мере увеличения объема опухоли и нарастания явлений внутричерепной гипертензии изменяется белковый состав как в очаге поражения, так и в перифокальной зоне, в которой эти сдвиги коррелируют со степенью злокачественности опухоли. При этом развиваются регионарные нарушения проницаемости гематоэнцефалического барьера, которые увеличивают цитотоксический отек. Определенную роль в этом процессе, по-видимому, играет обнаруженный недавно в головном мозге специфический белок — фактор проницаемости сосудов, стимулирующий ангиогенез в опухолевой ткани и повышающий проницаемость капилляров, причем обнаружена корреляция между концентрацией этого белка и выраженностью перифокального отека.
Изложенные предпосылки обосновывают поиски возможностей неинвазивного получения диагностической информации, характеризующей выраженность перифокального отека мозга при глиомах с учетом их локализации, величины и гистологических свойств.
По данным МРТ границы глиом и перифокального отека оптимально отличаются в Т2 режиме, поскольку интенсивность сигнала возрастает в зоне большого накопления экстрацеллюлярной жидкости. Рис 1(а)
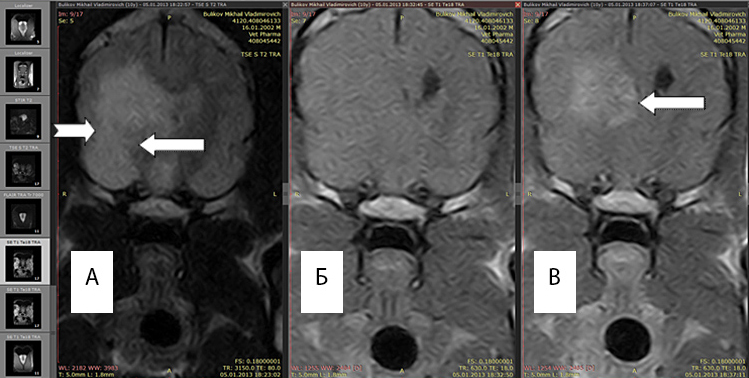 Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1А. Т2 режим, хорошо выражен перифокальный отек (белые стрелки).
Рис. 1Б. Т1 режим без введения контраста, отсутствует правый желудочек, имеется смещение срединных структур.
Рис. 1В. Т1 режим с введенным контрастным препаратом «Магневист». Регистрируется интенсивный сигнал от новообразования (обозначено стрелкой), перифокальный отек не виден.
Возможность выявления границ между опухолью и зоной перифокального отека повышается при повторном МРТ-исследовании после введения магнитоусиливающих препаратов (магневист). Поскольку магневист не проникает через неповрежденный гематоэнцефалический барьер, сопоставление томограмм, полученных до и после введения препарата, позволяет судить о регионарных нарушениях проницаемости барьера. Рис 1(A,B)
Это особенно отчетливо проявляется при астроцитомах типичной структуры, при которых функция гематопаренхиматозного барьера на границе опухоли и прилегающих участках мозга до определенного времени остается относительно сохранной, поэтому магневист не проникает в ткань опухоли.
В связи с этим зона гипоинтенсивности сигнала более отчетливо определяется в проекции астроцитомы, чем в области перифокального отека. Оценка размеров и распространения глиом более точна на МРТ, чем на КТ (Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. 2001; Коновалов A.Н., Корниенко В.Н. 1985; Коновалов А.Н., Корниенко В.Н., Пронин И.Н., 1997.; Yamada K., Soreusen A.G. 2000).
Существует большая точность и разрешающая способность МРТ в диагностике глиом полушарий мозга, этот метод не сопоставим с данными, полученными при КТ-исследовании. Он позволяет более точно определить вид опухоли, степень ее анаплазии и выраженность перифокального отека мозга, что имеет важное значение для выбора наиболее рациональной противоотечной терапии в процессе предоперационной подготовки и планирования хирургического вмешательства (рис. 2,3,4,5,6). На всех рисунках представлены справа результаты МРТ – изображения, а слева – КТ в аналогичных срезах.
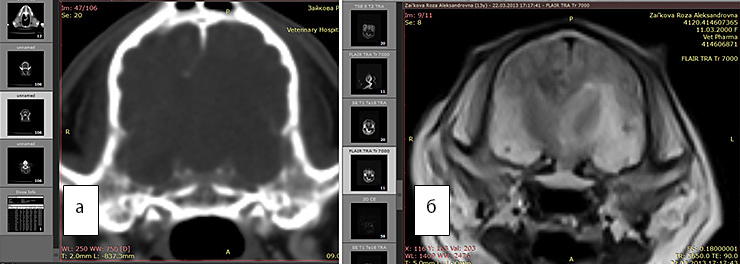
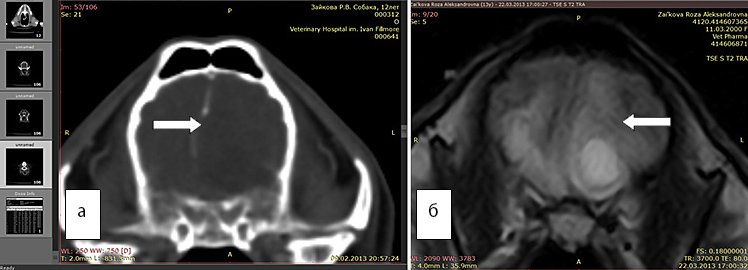 Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2 а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 2б. МРТ. Хорошо виден перифокальный отек
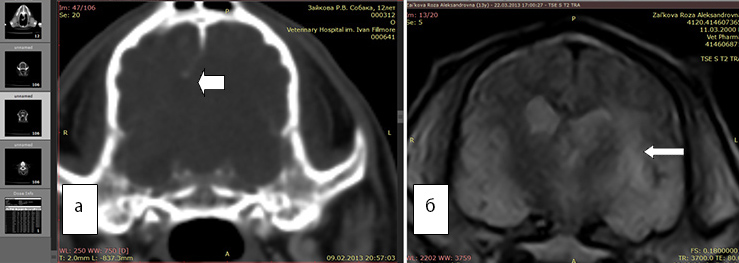 Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3а. КТ. Заметно смещение срединных структур (стрелка). Отек не виден
Рис. 3б. МРТ. Хорошо виден перифокальный отек
 Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4а. КТ. Заметно смещение срединных структур.Отек не виден
Рис. 4б. МРТ. Хорошо виден перифокальный отек. FLAIR последовательность
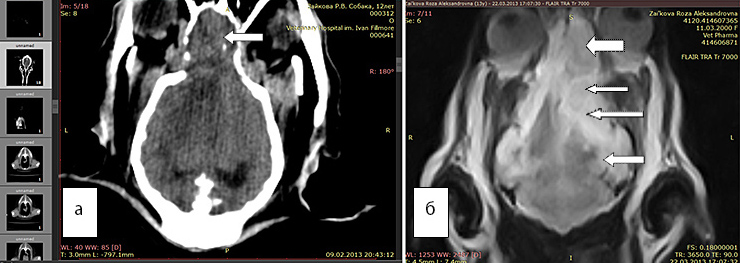 Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5а. КТ. Перифокальный отек плохо виден, но новообразование хорошо заметно (стрелка)
Рис. 5б. МРТ. Видно новообразование (большая стрелка), отек наиболее хорошо виден в программе FLAIR (маленькие стрелки)
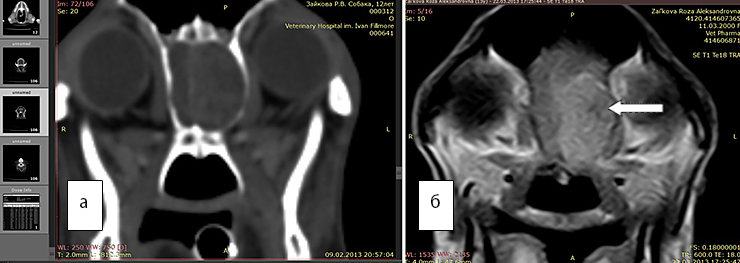 Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис 6а. КТ. В области обонятельной луковицы визуализируется новообразование
Рис. 6б. МРТ. Т1 режим с контрастом дает возможность гораздо точнее оценить объем новообразования, его границы
Представленные выше рисунки демонстрируют, что визуализация новообразования головного мозга, перифокального отека и его распространенности гораздо информативнее при использовании МРТ, чем КТ. Улучшить визуализацию помогает использование контраста, а также последовательного выполнения программ: для оценки перифокального отека целесообразно использовать FLAIR импульсную последовательность МРТ. Т2-взвешенные изображения, широко использующиеся для выявления патологических изменений, не всегда позволяют с достаточной надежностью различать зоны поражения и некоторые нормальные ткани. Так, на Т2-взвешенных изображениях зоны патологических изменений вещества мозга часто имеют высокий сигнал и выглядят как более яркие участки. Аналогичный высокий сигнал имеет также нормальная спинномозговая жидкость, что затрудняет выявление патологических очагов, располагающихся около пространств, заполненных данной жидкостью. Для преодоления данного недостатка разработана методика FLAIR (Fluid Attenuated Inversion Recovery), обеспечивающая подавление сигнала свободной воды (спинномозговой и некоторых других физиологических жидкостей) при сохранении базовой Т2-взвешенности изображения. FLAIR лучше выявляет очаговые изменения мозга.
Нельзя не отметить, что (по нашим данным наблюдения 35 пациентов) оценить наличие и размер перифокального отека при ЭЭГ – исследовании невозможно. Такая же ситуация существует и в гуманной медицине. Изменения биоэлектрической активности мозга (ЭЭГ) при глиальных опухолях неспецифичны и отражают реакцию мозга на поражение, развивающееся в нем. В дооперационном периоде ЭЭГ позволяет получить объективную информацию о функциональном состоянии мозга, выявить наличие и локализацию эпилептического очага у пациентов, имеющих эпилептические припадки (Фадеева Т.Н. 2004). Следует исходить из данных о том, что опухолевая ткань электрически нейтральна, поэтому на ЭЭГ нет отражения места локализации опухоли. Однако при проведении противоотечной терапии (дексаметазон 1мг/кг 2 раза в день) перед оперативным лечением либо при неоперабельных опухолях вместе с регрессом неврологических симптомов очень быстро происходит нормализация электрической активности головного мозга, что, несомненно, указывает на влияние перифокального отека на электрическую активность мозга.
Список литературы:
- Chan Р.Н., Fishmann R.A. Brain edema: induction in cortical slices by polyunsaturated fatty acids //Science. — 1978. — V.201, №5607. — P.358—360.
- Priden F.R., Tsayumu M., Reulen H.J. Measurement of vasogenic brain edema clearance into ventricular CSF //Surg. Forum. — 1979. — V.30, №5. — P. 446—453.
- S.Reulen H.J., Graber S., Huber P., Jto U. Factors off ecting the extension of peritumoral brain oedema ACT-study //Acta Neurochir. — 1988. — V.96, №1—2. — P. 19—24.
- Motta L., Mandara M. T., Skerritt G. C. Canine and feline intracranial meningiomas: an updated review. The Veterinary Journal, 192, 153-165. Source ChesterGates Animal Referral Hospital, Chester Gate Road, Telford Court, Unit E-F, Chester CH16LT, United Kingdom.
- Чувашова О.Ю. Характеристика перифокального отека при глиомах полушарий головного мозга различной степени анаплазии по данным компьютерной и магнитно-резонансной томографии. Институт нейрохирургии им. акад. А.П.Ромоданова АМН Украины, г. Киев. 2000.
- Кобяков Г.Л., Коновалов А.Н., Личиницер М.Р. и др. Современные возможности химиотерапии в лечении злокачественных опухолей // Современные минимально-инвазивные технологии (нейрохирургия, вертебрология, неврология, нейрофизиология): Материалы симпозиума. — СПб., 2001.—С. 251-253.
- Коновалов A.Н., Корниенко В.Н. Компьютерная томография в нейрохирургической клинике. — М.: Медицина, 1985.— С. 20—44.
- Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии. — М.: Видар, 1997.—С. 95-134.
- Yamada K., Soreusen A.G. Diagnostic imaging // Neurooncology. The Essentials. — New York, 2000. — Ch. 6. — P. 56 —77
Источник
