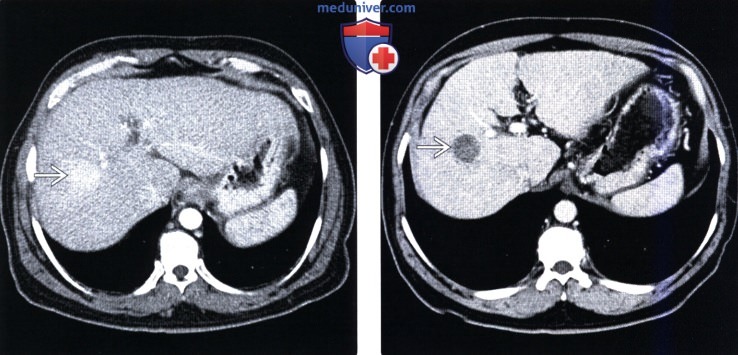
Отеки после операции на печени
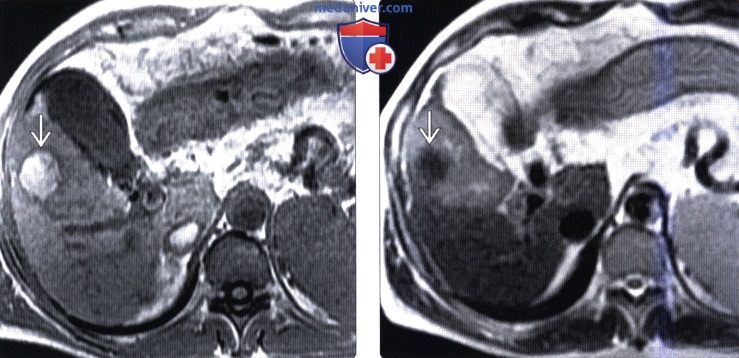
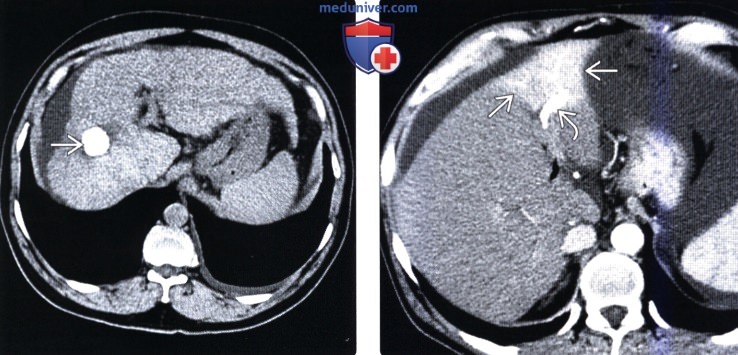
КТ изменения печени после операцииа) Определение: б) Визуализация: 1. Рекомендации по визуализации:
2. КТ изменений печени после операции: • Скопления газа в паренхиме печени или возле нее: • Газ в воротной вене, обусловленный причинами ятрогенного характера: • Злокачественная опухоль печени после химиоэмболизации:
• Ответ на системную химиотерапию: • Первичное резекционное вмешательство на печени: • Ятрогенная артерио-портальная фистула:
в) Дифференциальная диагностика изменений печени после операции: 1. Пиогенный абсцесс: 2. Газ в воротной вене на фоне инфаркта кишечника: 3. Очаговый сливной фиброз: 4. Периферическая холангиокарцинома: 5. Регенераторные и диспластические узлы: 6. Врожденное отсутствие сегментов печени: 7. Цирроз: 8. Ангиомиолипома печени: 9. Иные причины возникновения преходящих различий плотности и интенсивности печени (ПРПП и ПРИП): г) Клинические особенности. Демография: д) Диагностическая памятка. Следует учесть: е) Список использованной литературы: – Также рекомендуем “Лучевая диагностика трансъюгулярного внутрипеченочного портосистемного шунтирования (ТВПШ)” Редактор: Искандер Милевски. Дата публикации: 27.2.2020 |
Источник
Продолжительное время печень считалась хирургами «неприкасаемым» органом из-за высокой смертности пациентов во время и после операции. В последние десятилетия хирургические вмешательства стали распространены благодаря внедрению новых технологий и совершенствованию оперативных методик.
Проведение резекции (удаление части) органа сделало излечимыми ранее смертельные заболевания: первичные опухоли и метастатическое поражение печени. Резекция печени при злокачественных новообразованиях может выступать как самостоятельный метод лечения, так и комбинироваться с химио- или лучевой терапией.
Показания
Основные показания к удалению части печени — объемное образование любой локализации или обширная травма, не поддающаяся ушиванию. Среди объемных образований лидирующую позицию занимают отдаленные метастазы из других органов. Наиболее часто к метастатическому поражению печени приводят злокачественные новообразования органов малого таза, легких, желудка и колоректальный рак. Несмотря на значительный прогресс в лечении онкологических заболеваний, хирургическое вмешательство наряду с химиотерапией остается одним из основных методов лечения метастазов печени.
Еще одно показание к операции — первичные злокачественные новообразования печени: гепатоцеллюлярная карцинома, гепатобластома, цистаденокарцинома и другие. Эти опухоли характеризуются агрессивным течением, без своевременного лечения быстро растут в толщу органа и дают метастазы в другие органы.
Наиболее частое злокачественное новообразование печени — гепатоцеллюлярная карцинома. Она составляет более 85% всех первичных онкологических заболеваний органа. Оперативное лечение гепатоцеллюлярной карциномы возможно на стадиях I-III. На четвертой стадии возможность проведения резекции рассматривается индивидуально.
Среди других объемных образований печени, которые требуют хирургического лечения, являются:
- гемангиомы больших размеров;
- другие редко встречающиеся доброкачественные новообразования: цистаденомы, аденомы желчных протоков, миелолипомы, мезотелиомы, нейрофибромы;
- эхинококковые кисты;
- абсцессы;
- кисты.
Показанием к хирургическому вмешательству на печени также может стать ряд заболеваний: описторхоз, аспергиллез, туберкулез, сифилис. При этих инфекционных болезнях в органе также могут возникать очаги деструкции или воспаления.
Виды
Все резекции можно разделить на две большие группы: атипичные и типичные. К первым относятся краевая, клиновидная и поперечная резекции — операции, направленные на удаление периферических отделов печени. Атипичные хирургические вмешательства выполняются с учетом топографии кровеносных и венозных сосудов, а также желчных протоков.
Типичные резекции — анатомически обоснованные хирургические вмешательства, которые выполняются с учетом долевого и сегментарного строения органа. Печень условно делится на две большие части — правую и левую доли. Каждая из них имеет автономное кровоснабжение из печеночной артерии и воротной вены. В свою очередь, доли состоят из сегментов (по 4 с каждой стороны). Они также имеют изолированное кровоснабжение и отток желчи.
Относительная автономность отдельных участков — основной фактор, позволяющий проводить удаление одного или нескольких сегментов печени без влияния на здоровую ткань органа. В зависимости от объема операции, типичные резекции бывают нескольких видов:
- гемигепатэктомия — удаление одной из двух долей (или 4 сегментов) печени;
- право- и левосторонние латеральные лобэктомии — удаление 6 и 7 или 2 и 3 сегментов соответственно;
- право-и левосторонние парамедианные лобэктомии — резекция 5 и 8 или 3 и 4 сегментов;
- расширенные гепатэктомии — правосторонняя (удаление 4-8 сегментов), левосторонняя — 2-8 сегмента;
- сегментэктомии и бисегментэктомии — удаление одного или двух близлежащих сегментов.
Типичные и атипичные операции имеют свои преимущества и недостатки. Например, при типичных резекциях соблюдается принцип анатомичности и меньше риск кровотечения. Однако, даже при небольшом патологическом очаге, приходится удалять минимум один сегмент печени. Атипичные резекции более экономные и щадящие, но имеют более высокий риск как интраоперационных, так и послеоперационных осложнений.
Предоперационное обследование и подготовка
Хирургическое вмешательство на печени не проводится без полного лабораторно-инструментального обследования. Диагностический минимум включает в себя:
- общеклинические анализы крови (общие, биохимический крови, коагулограмма);
- определение группы и резус-фактора;
- исследование на маркеры вирусных гепатитов, ВИЧ, сифилис;
- ФГДС (фиброгастродуоденоскопия);
- рентгенография органов грудной клетки;
- инструментальные исследования, направленные на визуализацию печени, других органов брюшной полости и отдаленных метастазов при опухолевом процессе (УЗИ органов брюшной полости, компьютерная и/или магнитно-резонансная томография).
Большое значение при подготовке к хирургическому вмешательству имеет правильная оценка функциональных резервов печени. Это позволяет предположить степень поражения органа и операционные риски. Определение функционального состояния печени проводится по международной классификации Чайлд-Пью. Высокий операционный риск имеют пациенты при наличии следующих состояний:
- варикозным расширением вен пищевода, особенно с кровотечением из них в анамнезе;
- гипоальбуминемия — снижение белка альбумина в крови;
- снижение уровня протромбина — вещества, участвующего в процессах свертывания крови.
Перед оперативным вмешательством обязательно проводится коррекция метаболических и других изменений, вызванных заболеваниями печени. Так, если у пациента имеется желтуха, назначается внутривенная инфузионная терапия, направленная на детоксикацию организма. При асците (наличие невоспалительной жидкости в брюшной полости) выполняется дозированная эксфузия выпота. В случае нарушения свертывающей способности крови проводится трансфузия плазмы или отдельных факторов свертывания.
При первичном злокачественном новообразовании печени и метастатическом поражении, не поддающимся хирургическому лечению или требующем обширной резекции, прибегают к сеансам химиоэмболизации. Этот метод представляет собой разновидность местной химиотерапии.
Химиотерапевтические препараты вводятся через катетер, проведенный через бедренную артерию до ветвей печеночной артерии, кровоснабжающих опухолевый узел. Благодаря прямому цитотоксическому действию этих лекарств уменьшаются размеры опухоли или метастаза, что позволяет провести резекцию у ранее неоперабельных пациентов или уменьшить объем операции.
Наркоз
Перед хирургическим вмешательством пациента обязательно осматривает анестезиолог. Он оценивает общее состояние и саму возможность проведения операции, а также прогнозирует течение общей анестезии (наркоза) и возможные риски от нее.
При операциях на печени используется многокомпонентная ингаляционная эндотрахеальная анестезия. Для анестезиологического обеспечения используют несколько групп лекарственных средств, избирательно влияющих на функции организма (угнетение сознания, чувствительности, памяти, устранение боли).
Выбор препаратов для ввода в наркоз и его поддержания — один из ответственных этапов подготовки к хирургическому вмешательству. К этому процессу врач-анестезиолог подходит с большой ответственностью, так как некоторые наркозные средства угнетают функцию печени и могут привести к появлению или усугубят имеющуюся функциональную недостаточность органа.
Общие принципы операций на печени
Негласным правилом в гепатологии считается, что удаление более 70% тканей органа при здоровой или более 60% при нарушенной печеночной функции приводит к тяжелым послеоперационным осложнениям. Это связано с неспособностью оставшейся части печени справиться со своими метаболическими обязанностями.
Технические проблемы при вмешательствах на печени обусловлены несколькими факторами:
- сложность создания полноценного оперативного доступа к органу;
- богатое кровоснабжение печени, приводящее к повышенному риску массивного кровотечения;
- большое количество трубчатых структур (сосуды, желчные пути), требующих перевязки перед пересечением;
- мягкая консистенция органа обуславливает сложность его ушивания.
Для нивелирования перечисленных сложностей используется ряд оперативных приемов и техник. Во-первых, при хирургических вмешательствах на печени используется специальный инструментарий: реберные ретракторы, электрокоагуляторы с дополнительными насадками и ножи, ультразвуковые деструкторы-аспираторы, сосудистые зажимы для печеночных вен, клипаторы для сосудов и желчных протоков, аппараты для реинфузии (обратное вливание) крови, гемостатические пленки и губки.
Во-вторых, для обеспечения хорошего поля деятельности прибегают к специальным хирургическим доступам. Они предполагают большие разрезы, проходящие как по правой половине грудной клетки, так и по передней брюшной стенке. Существует более 70 модификаций доступов к печени (по Куино, Петровского-Почечуеву, Боровскому и другие). Большинство из них являются травматичными, а некоторые предполагают и резекцию участков ребер.
Выбор доступа осуществляется индивидуально, исходя из объема планируемой резекции. Однако общепризнанным и самым удобным признается двухподреберный доступ с вертикальным продолжением. Он предполагает разрезы под реберными дугами и по срединной линии живота. Мечевидный отросток грудины при этом удаляется. Основные преимущества этого доступа — удобство работы при любом типе операции и широкое рабочее поле для хирургов.
В-третьих, оперативная техника на печени предполагает использование специальных приемов. Например, для ушивания раны используются специальные гемостатические швы. Их выполняют тупоконечной атравматической иглой и нитью. Для быстрого и прочного ушивания наглухо сосудов или желчных путей также могут применяться клипаторы. В ходе хирургического вмешательства также нередко прибегают к интраоперационному УЗ-исследованию печени и другим инвазивным методам исследования.
Основные этапы резекции печени
Хирургическое вмешательство по резекции печени состоит из нескольких последовательных шагов:
- послойное вскрытие передней брюшной стенки и остановка кровотечения из поврежденных сосудов кожи, подкожно-жировой клетчатки и мышц;
- мобилизация печени и выделение элементов глиссоновой ножки — пересечение ряда связок, перевязка трубчатых структур (вены, артерии, желчные протоки);
- разделение паренхимы (основной ткани) печени и резекция органа;
- гемостаз оставшейся части печени и профилактика желчеистечения;
- постановка дренажных трубок и контрольная ревизия брюшной полости;
- ушивание операционной раны.
Доступ к печени осуществляется одним из перечисленных способов при помощи скальпеля или электроножа. Капиллярное кровотечение из поврежденных сосудов останавливают методом электрокоагуляции, после чего разъединяют мышечные пучки передней брюшной стенки и вскрывают брюшину. После визуализации печени приступают к ее мобилизации. Она начинается с рассечения круглой связки.
Затем пошагово приступают к пересечению связочного аппарата в зависимости от вида операции. Следующий этап — визуализация и перевязка трубчатых структур глиссоновой ножки. Существует несколько методов хирургической обработки сосудов печени:
- в воротах органа до его рассечения;
- перевязка по мере обнаружения во время резекции с временным пережатием глиссоновой ножки печени, расположенной у ворот печени;
- смешанная техника, объединяющая в себе элементы первых двух методик.
Один из самых ответственных и опасных этапов операции — перевязка и рассечение правой или левой печеночной вены. Всегда существует риск соскальзывания нити или наложенного зажима с культи вены. При этом развивается неконтролируемое кровотечение, и появляется риск воздушной эмболии (засасывание воздуха в венозную систему). Для профилактики такого осложнения перед обработкой печеночной вены проводят лигатуру под ее основной ствол — нижнюю полую вену. Это позволяет временно пережать крупный венозный сосуд и прошить печеночную вену заново.
После обработки всех трубчатых структур производят удаление пораженной части печени. После тщательного гемо- и желчестаза проводят контрольный осмотр брюшной полости. Завершающие этапы операции — постановка дренажей для оттока сукровичного отделяемого и ушивание раны.
Восстановительный период
Течение послеоперационного периода во многом зависит от общего здоровья пациента и функционального состояния оставшейся части печени. В раннем послеоперационном периоде пациент находится в отделении реанимации под пристальным присмотром медицинского персонала. Основными задачами на этом этапе являются:
- поддержание жизненно-важных функций;
- адекватное обезболивание наркотическими и ненаркотическими анальгетиками;
- контроль за функцией печени;
- профилактика послеоперационных осложнений;
- уход за послеоперационной раной и дренажами;
- адекватная инфузионно-трансфузионная терапия;
- парентеральное введение сбалансированных питательных смесей, а затем постепенный переход на обычное здоровое питание.
В раннем послеоперационном периоде пациенту следует соблюдать постельный режим, уделять больше времени отдыху и придерживаться всех рекомендаций лечащего врача. В поздние реабилитационные сроки (более 1 месяца с операции) пациент может вернуться к привычному образу жизни с ограничениями по физическим нагрузкам и питанию. Кроме того, в этот период обязательно проводится полноценное контрольное обследование основных систем органов, печени и ее функциональной активности.
Возможные осложнения и прогноз
Послеоперационные риски резекции печени во многом зависят от объема операции. Самые грозные осложнения — массивное кровотечение в брюшную полость, печеночная недостаточность и тромбоэмболия (отрыв тромба и его перенос по сосудистому руслу) легочной артерии или ее ветвей. Частота этих осложнений коррелирует с тяжестью операции — чем больше объем хирургического вмешательства, тем выше риск перечисленных осложнений.
Среди менее опасных осложнений — скопление жидкостных образований (крови, невоспалительной серозной жидкости) в брюшной полости, нагноение послеоперационной раны и несостоятельность швов, появление выпота в плевральной полости.
При резекции по поводу первичного рака печени прогноз неоднозначный — он зависит от возраста и состояния пациента, стадии и размера опухоли. Неблагоприятными факторами являются:
- возраст старше 40-45 лет;
- наличие участка некроза в ткани опухоли;
- высокая степень злокачественности новообразования;
- поражение опухолью правой доли печени;
- наличие цирроза печени и выраженной печеночной недостаточности.
Продолжительность жизни после резекции печени у этой группы онкобольных в сроки до 5 лет составляет от 37 до 50%. Рецидив злокачественного новообразования наблюдается у части пациентов, однако риск его развития во многом определяется качеством проведенного оперативного вмешательства. В Европейской клинике данную операцию проводят квалифицированные хирурги с большим опытом работы.
Источник