Нейрогенный отек легких что это
Дыхательная недостаточность является одним из наиболее часто развивающихся внечерепных осложнений острой церебральной патологии – различных острых заболеваний и травм головного мозга (ГМ). Она возникает в среднем у 80% пациентов с тяжелым повреждением центральной нервной системы (ЦНС). Ее развитие может существенным образом утяжелять состояние пациента, негативно сказываться на течении основного заболевания и в ряде случаев становиться самостоятельной клинической проблемой, требующей применения дополнительных средств и методов лечения.
Справочная информация. Дыхательная недостаточность – состояние организма, при котором либо не обеспечивается поддержание нормального газового состава артериальной крови, либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных возможностей организма, либо поддерживается искусственным путем. Для острой дыхательной недостаточности характерны: одышка и диспноэ (изменение частоты, ритма и глубины дыхания), участие в акте дыхания вспомогательной мускулатуры, тахикардия, артериальная гипертензия или гипотензия, цианоз, когнитивные нарушения, угнетение сознания, делирий.
Наиболее частыми причинами дыхательной недостаточности являются вентилятор-ассоциированная пневмония и острый респираторный дистресс-синдром (ОРДС). Но, наряду с ними, многие авторы выделяют также такое осложнение острого повреждения ГМ, как нейрогенный отек легких (НОЛ). Наличие специфической связи между повреждением ЦНС и развитием отека легких подтверждают данные, полученные при кондиционировании доноров органов (по данным D. McKeown et al., НОЛ у пациентов со смертью ГМ развивается в 13 – 18% случаев [2012]).
Чаще всего НОЛ диагностируют при нетравматических субарахноидальных кровоизлияниях (САК) и черепно-мозговой травме (ЧМТ). Развитие НОЛ описано также при таких заболеваниях ЦНС, как эпилепсия, опухоли ГМ, рассеянный склероз, но эти сведения носят единичный характер и не поддаются системному анализу.
В настоящий момент нет точных данных о частоте развития НОЛ при различных острых заболеваниях и травмах ГМ. Это связано с объективными трудностями дифференциальной диагностики НОЛ с другими видами отека легких. Например, при САК частота возникновения НОЛ, по данным различных авторов, варьирует от 2 до 23%. При этом она находится в прямой взаимосвязи с возрастом пациента, сроками хирургического вмешательства, локализацией аневризм в вертебрально-базилярном бассейне, а также со степенью тяжести состояния по шкале Hunt-Hess и с рентгенологическими признаками выраженности кровоизлияния по градации Fisher.
Патогенез НОЛ до конца не изучен. В настоящее время наиболее обсуждаемой теорией возникновения НОЛ является предложенная L. Mascia в 2009 году теория «двойного удара». Она заключается в последовательном воздействии на легкие двух групп повреждающих факторов. Первую волну агрессии вызывают провоспалительные цитокины, фактор некроза опухоли и другие медиаторы системной воспалительной реакции. Их источником являются микроглия и астроциты, которые в большом количестве выбрасывают эти медиаторы воспаления при остром повреждении ГМ. Кроме того, росту концентрации в крови этих веществ способствует возникающее в результате прямого поражения ЦНС повышение проницаемости гематоэнцефалического барьера. Вследствие воздействия на эндотелий легочных капилляров провоспалительных веществ происходит увеличение его проницаемости, что на фоне активации симпатоадреналовой* системы, вызывающей повышение давления в малом круге кровообращения, приводит к перемещению воды, электролитов, крупных белковых молекул и форменных элементов крови в интерстициальное пространство легких, а в последующем и в альвеолы (* в патогенезе развития НОЛ в настоящее время многие исследователи отводят ведущую роль активации симпатической нервной системы, возникающей при остром повреждении ГМ, с последующей гиперкатехоламинемией). По-сути – это ОРДС [взрослых]. Вторым же «ударом» авторы теории считают повреждение легких, возникающее в результате воздействия искусственной вентиляции (ИВЛ), проводимой на фоне уже имеющегося ОРДС. Применение высокого дыхательного объема способствует возникновению баро- и волюмотравмы, а использование неправильно подобранного положительного давления в конце выдоха (ПДКВ) вызывает ателектотравму легочной паренхимы. Более того, легкие пациентов с острыми заболеваниями и травмами ГМ после «первого удара» становятся более восприимчивы ко вторичным факторам агрессии. При этом механически повреждаемые при проведении ИВЛ они сами становятся источником факторов воспаления, которые вызывают их дополнительное повторное поражение.
Обратите внимание! В теории «двойного удара» модель повреждения легких при остром повреждении ГМ по своей сути практически ничем не отличается от ОРДС, который формируется при травматической болезни, сепсисе, панкреонекрозе и иных патологических состояниях, сопровождающихся системной воспалительной реакцией, с той лишь разницей, что источником медиаторов воспаления, индуцирующих дальнейший каскад патофизиологических изменений, является поврежденный ГМ. [!!!] Это позволяет в настоящий момент рассматривать НОЛ как особую форму ОРДС, диагностируемую на основании общепринятых критериев, дополненных наличием тяжелого повреждения ЦНС и отсутствием связи с иными этиологическими факторами.
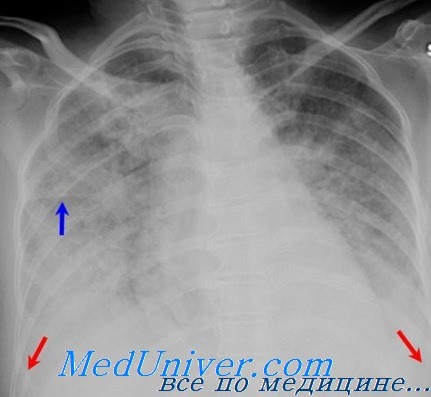
Справочная информация. Клинические признаки ОРДС [взрослых] могут быть вначале невыраженными и оставаться незамеченными: могут развиваться в течение нескольких часов или дней, например, при сепсисе (т.е. имеет место «светлый промежуток» между воздействующим фактором и началом клинических проявлений – от 10 – 12 ч до 2 – 3 дней). Иногда развитие ОРДС совпадает с инцидентом, который может вызвать это осложнение (например, аспирация желудочного содержимого). Общие признаки – одышка, сухой кашель, дискомфорт за грудиной, состояние неполной адекватности. Более отчетливые признаки появляются при умеренно выраженной или тяжелой форме ОРДС. В этот период развивается цианоз. При аускультации легких – бронхиальное дыхание, возможны грубые крипитирующие хрипы. Состояние пациента ухудшается: у него нарастает тяжелая дыхательная недостаточность по гипоксемическому варианту. ОРДС достигает пика в среднем через 24 – 48 часов от начала повреждения и заканчивается массивным, обычно двусторонним поражением легочной ткани (на прямой рентгенограмме грудной клетки видны инфильтраты в обоих легких, т. е. двустороннее поражение).
[увеличить]читайте также статью «Острый внелегочный респираторный дистресс-синдром: определение, этиопатогенез, клинические и лабораторные проявления (обзор литературы с элементами критики)» В.Л. Кассиль (журнал «Клиническая онкогематология» №1, 2011) [читать]
Описано две клинические формы НОЛ. [1] Первая носит название фульминантной и характеризуется быстрым развитием в течение первых нескольких часов после острого повреждения ГМ. Возникновение этой формы связано с высокой летальностью пациентов. По разным оценкам, она составляет от 60 до 100%. [2] Вторая форма носит название отсроченной и возникает через 12 – 24 ч после тяжелого поражения ГМ. Летальность при этом варианте НОЛ составляет около 50%.
Эффективные методы оценки риска развития данного состояния, средства его профилактики или методы воздействия на отдельные звенья его патогенеза не разработаны. Ключевой задачей в лечении НОЛ является поддержание газообмена. Ведущая роль в этом отводится [!!!] ИВЛ, которую рекомендовано проводить с использованием принципов протективной вентиляции легких. При этом реализацию отдельных подходов к профилактике вентиляториндуцированного повреждения легких целесообразно проводить только в условиях мониторинга внутричерепного давления (ВЧД).
по материалам статьи «Нейрогенный отек легких» В.И. Шаталов, А.В. Щеголев, А.Н. Грицай, В.С. Афончиков; ФГБВОУ ВО «Военно-медицинская академия им. С. М. Кирова» МО РФ, Санкт-Петербург: ГБУ «Санкт-Петербургский научно-исследовательский институт скорой помощи им. И.И. Джанелидзе», Санкт-Петербург (журнал «Вестник анестезиологии и реаниматологии» №1, 2018) [читать]; Читайте также:
статья «Компьютерная томография в диагностике острого респираторного дистресс-синдрома у пациентов с тяжелой черепно-мозговой травмой» Агафонова Н.В., ФГЛПУ «Научно-клинический центр охраны здоровья шахтеров» г. Ленинск-Кузнецкий (журнал «Политравма» №1, 2006) [читать];
Источник
Осложнения со стороны дыхательной системы при черепно-мозговой травме (ЧМТ). Нейрогенный отек легкихСмертность и инвалидизация после острой травмы мозга определяются не только тяжестью самой травмы, но и развитием осложнений. Возникновение системных осложнений неудивительно, учитывая что мозг контролирует большую часть систем организма с помощью гуморальных, биохимических, вегетативных и невральных механизмов обратной связи. Анатомическое или физиологическое повреждение этих центральных систем неизбежно ведет к дисфункции связанных с ними органов. Угнетение сознания является признаком повреждения мозга:
Дополнительные факторы риска развития пневмонии у пациентов с поврежлениями мозга: Нейрогенный отек легкихЭто отек легких с острым началом, обычно возникающий через 4-12 часов после повреждения мозга, но возможно и отсроченное проявление. – Также рекомендуем “Сердечно-сосудистые осложнения при черепно-мозговой травме (ЧМТ). Нарушения водно-электролитного обмена” Оглавление темы “Ведение пациентов с травмой мозга”:
|
Источник
Нейрогенный отек легких. Нейрогенный отек легких после сеанса гемодиализа
Нейрогенный отек легких после сеанса гемодиализа
Neurogenic pulmonary oedema post-haemodialysis. Andrew Davenport (NDT Plus, Volume 1, Number 1, Feb 2008, https://ndtplus.oxfordjournals.org/cgi/content/full/1/1/41)
Введение
Существует множество причин развития отека легких (см. таблицу ниже). У пациентов с почечной недостаточностью отек легких обычно развивается в условиях повышенного давления в легочных артериях в связи с увеличением объема экстрацеллюлярной жидкости, что является следствием междиализного набора веса и невозможностью достижения «сухого веса» или «постдиализного целевого веса», часто в сочетании с нарушением функции сердца. Накопление интерстициальной жидкости в легких также может происходить и при состояниях, характеризующихся нормальным давлением в легочных артериях.
Таблица 1. Причины отека легких
> ГД > ЭП Полиорганная недостаточность +++ +++ +++ ++ — + Печеночная недостаточность ++ +++ +++ — — — Почечная недостаточность ++ + +++ — — — Нейрогенный отек +++ + +++ — — — Перегрузка объемом +++ + — — — — Эмболия легочных сосудов +++ — +++ — — — Сердечная недостаточность +++ + ++ — — — Карциноматоз — ++ ++ +++ — — Высокогорный отек легких +++ + +++ — — — Реэкспансионный отек легких + — +++ — +++ —
ГД — гидростатическое давление, OД — онкотическое давление, ЭП — проницаемость эндотелия, ЛД — лимфодренаж, ИД — интерстициальное давление, С — сурфактант.
Легочные осложнения наблюдаются при острой и хронической печеночной недостаточности. Печеночно-легочный синдром (hepatopulmonary syndrome) связан с чрезмерной дилатацией легочных сосудов и повышением уровня вазопрессина, катехоламинов и усилением активности симпатической нервной системы, что приводит к шунтированию с нарушением соотношения вентиляция/перфузия (увеличение) [1]. Кроме того, накопление циркулирующих эндотоксинов и провоспалительных цитокинов приводит к активации эндотелия и усилению образования интерстициальной жидкости [2]. Усиливает эти эффекты уменьшение онкотического давления коллоидов плазмы.
В случаях нейрогенного отека легких, накопление интерстициальной жидкости происходит в результате увеличения легочного гидростатического давления и активации эндотелия [3]. В статье описан случай острого отека легких (нейрогенного), развившегося после интермиттирующего гемодиализа через 9 дней после приема парацетамола – суицидальной попытки.
Описание случая
Пациентка в возрасте 30 лет поступила в стационар через 2 дня после приема 50 г парацетамола, с нарушением функции печени, и следующими лабораторными показателями: лактат 13 ммоль/л (в норме
Таблица 2. Результаты лабораторных обследований
До проведения диализа Непосредственно после диализа Через 6 часов после диализа Натрий (ммоль/л) 132 139 135 Калий (ммоль/л) 6,0 4,1 5,2 Мочевина (ммоль/л) 17,2 9,6 11,2 Креатинин (мкмоль/л) 328 205 234 Глюкоза (ммоль/л) 6,4 4,2 5,4 Осмолярность (мосм/кг) 299,6 300 297
Осмолярность = (натрий + калий) * 2 + глюкоза + мочевина.
К концу сеанса гемодиализа у пациентки появилось возбуждение и жалобы на усиление одышки, с прогрессирующим ухудшением. При аускультации выслушивался третий тон сердца и распространенные хрипы в легких. При рентгеновском обследовании грудной клетки обнаружен выраженный отек легких, и развилась гипоксия: PaO2 9,3 кПа (в норме 12–14,5) [70 мм рт. ст. в норме 90–109], PaCO2 5,9 кПа (в норме 4,7–6,0) [44 мм рт. ст. в норме 35–45], pH 7,34 (в норме 7,35–7,45), с избытком оснований – 4,6 (в норме ±2), лактат 5,4 ммоль/л (норма
Пациентка переведена в отделение интенсивной терапии помощи, проведена интубация с последующей вентиляцией легких, и рекомендована непрерывная гемодиафильтрация. Сердечный выброс составил 11,0 л/мин (показатели неинвазивного мониторинга). Больная была экстубирована через 2 дня и заместительная почечная терапия отменена через 3 дня, в связи с усилением мочеотделения. Однако сохранялось нарушение сознания, с некоординированными движениями глазных яблок, при КТ выявлена энцефалопатия (отек ствола мозга), связанная с повышением проницаемости сосудов. Через несколько дней ее состояние улучшилось, и пациентка была выписана без каких-либо неврологических остаточных явлений.
Обсуждение
В обычной нефрологической практике самой распространенной причиной отека легких у гемодиализных больных является повышение гидростатического давления в легких в связи с перегрузкой внеклеточной жидкости, часто в сочетании с дисфункцией левого желудочка. Также отек легкого может развиваться в результате воспалительного поражения легочного эндотелия, что приводит к повышению его проницаемости, при таких состояниях, как инфекции, васкулиты, действие лекарственных препаратов и компонентов крови, токсинов, лучевого поражения, нарушения функции печени или выраженной уремии [1]. В редких случаях отек легких развивается при обструкции лимфатических сосудов легких, выраженного снижения давления коллоидов плазмы и интерстициального давления альвеолярной ткани (см. таблицу 1). Нейрогенный отек развивается в результате выраженной вазоконстрикции под влиянием симпатической активации – при ишемическом повреждении ядра одиночного пути в продолговатом мозге и/или его связей с гипоталамусом. В результате системной вазоконстрикции происходит перемещение крови из системного кровотока в систему легочного кровообращения, что приводит к выраженной легочной гипертензии, которую осложняет спазм легочных вен, еще более усиливающий капиллярное гидростатическое давление в легких. Развивается гидростатический отек, затем эндотелиальное повреждение и увеличение местной проницаемости [3].
Отек мозга может развиваться при острой печеночной недостаточности, особенно при отравлении парацетамолом [4]. Так, одной из причин смерти при острой печеночной недостаточности является ущемление мозжечка, в данном случае у пациентки имелась дискоординация движений глазных яблок, связанная со сдавлением ствола мозга. Обычно повреждение печени бывает наиболее выраженным через 3-4 дня после передозировке, и затем начинается улучшение (у пациентов, которые выживают без трансплантации печени) [4]. Нарушение функции почек у данной пациентки произошло как в результате влияния острой печеночной недостаточности, так и вследствие токсического действия одного из метаболитов парацетамола – N-ацетил-p-бензохинона, который повреждает почечные канальцы и может приводить к острому повреждению почек на 7-10 день после отравления, если у пациента не развилась тяжелая печеночная недостаточность [6].
Несмотря на то, что данная пациентка приняла потенциально летальную дозу парацетамола, она поступила в стационар через несколько часов после отравления, и быстро была начата терапия n-ацетилцистеином, которая была продолжена и в отделении интенсивной терапии [4]. Ацетилцистеин уменьшает степень печеночного повреждения и увеличивает вероятность спонтанного выздоровления [4].
Известно, что обычный интермиттирующий гемодиализ может вызывать умеренный отек мозга у пациентов с хроническим заболеванием почек, которым назначается гемодиализная терапия. Интермиттирующий гемодиализ/ультрафильтрация может привести к гибели пациентов с уже имеющимся отеком мозга, например, при острой печеночной недостаточности, в связи с усилением отека мозга [7]. Существует несколько теорий, объясняющих этиологию увеличения отека мозга в таких случаях. При интермиттирующем гемодиализе быстро снижается уровень мочевины в плазме в течение первых двух часов [8]. Переход мочевины через клеточные мембраны происходит приблизительно в 20 раз медленнее, чем переход воды [9]. Таким образом, несмотря на быстрое снижение уровня мочевины в плазме, концентрация мочевины в тканях остается высокой, что создает градиент онкотического давления и приводит к диффузии воды в ткани (для выравнивания разницы осмотического давления). Кроме того, поступление бикарбоната из диализата (с высокой концентрацией бикарбоната) повышает рН плазмы [10], однако не приводит к переходу иона бикарбоната через клеточную мембрану. Это вызывает нарушение баланса между концентрациями бикарбоната и диоксида углерода, с парадоксальным развитием внутриклеточного ацидоза, что приводит к угнетению дыхательного центра и нарушению компенсаторных процессов нейтрализации внутриклеточного ацидоза [11], а также к увеличению
Так как объем субтенториального пространства весьма ограничен, клинические проявления возникают даже при небольшой степени отека мозга. Уже давно известно, что пациенты с острой печеночной недостаточностью могут погибнуть в результате ущемления мозжечка, в связи с увеличением давления в субтенориальном пространстве [13]. В описываемом случае повышение внутричерепного давления в этой области привело к сдавлению ствола мозга и последующему нейрогенному отеку легких, при выздоровлении у пациентки отмечались некоординированные движения глазных яблок. При печеночной недостаточности может иметься нарушение кровоснабжения головного мозга, и принудительная ультрафильтрация может еще более нарушать мозговой кровоток, и, как следствие, эффект отдачи в отношении внутричерепного давления, в результате резкого снижения перфузионного давления мозга [14]. Также относительно частым осложнением интермиттирующего гемодиализа является гипотония [14]. Гипотония может приводит к снижению церебрального кровотока у пациентов с острой печеночной недостаточностью.
По данным некоторых авторов, следует принимать ряд мер для поддержания сердечно-сосудистой стабильности у тяжелых пациентов при проведении интермиттирующего гемодиализа [15,16]. Этот подход в описываемом случае был реализован использованием диализата с высокой концентрацией натрия (в сравнении с плазменной), охлажденного, применением синтетических биосовместимых диализаторов и низкой скорости кровотока, ультрафильтрацией 200 мл/час, без антикоагуляции. После сеанса диализа осмолярность плазмы не изменилась. Однако, несмотря на предпринятые меры, быстро наступило ухудшение состояния пациентки, в связи с вазогенным отеком заднего мозга и развитием нейрогенного отека легких.
После приема парацетамола (суицидальная попытка) прошло 9 дней, и не имелось каких-либо признаков печеночной комы, восстановление головного мозга произошло не полностью, и сохранялась повышенная чувствительность к гемодиализ-индуцированному повреждению.
Ранее уже описывались случаи гибели пациентов при отравлении парацетамолом от отека мозга, несмотря на начальное улучшение состояния и хороший прогноз [5]. В меньшей степени на внутричерепное давление оказывает влияние низкообъемная непрерывная заместительная почечная терапия, и этим методам следует отдавать предпочтение у пациентов с высоким риском отека мозга [17].
Какие выводы следует делать из данного случая:
1) Пациенты с острой печеночной недостаточностью имеют повышенный риск развития отека мозга
2) Даже если отсутствуют клинические признаки печеночной энцефалопатии, это не означает, что функции головного мозга находятся в норме
3) Интермиттирующий гемодиализ может приводить к накоплению внутримозговой интерстициальной жидкости
4) Несмотря на то, что был использован диализат с высокой концентрацией натрия, охлажденный, установлена низкая скорость кровотока, интермиттирующий гемодиализ привел к ухудшению состояния пациентки
5) У пациентов с повышенным риском отека мозга предпочтительно применять низкообъемные непрерывные методы проведения заместительной почечной терапии, так как они в меньшей степени приводят к нарушению мозгового кровотока и внутричерепного давления
Литература
1. Varghese J, Ilias-Basha H, Dhanaseliaran R, et al. Hepatopulmonary syndrome—past to present. Ann Hepatol (2007) 6:135–142.
2. Leaver SK, Evans TW. Acute respiratory distress syndrome. Br Med J (2007) 335:389–394.
3. Baumann A, Audibert G, McDonnell J, et al. Neurogenic pulmonary oedema. Acta Anaesthesiol Scand (2007) 51:447–455.
4. Larson AM. Acetaminophen hepatotoxicity. Clin Liver Dis (2007) 11:525–548.
5. Jalan R. Intracranial hypertension in acute liver failure: pathophysiological basis of rational management. Semin Hepatol (2003) 23:271–282.
6. Davenport A, Finn R. Paracetamol (acetaminophen) poisoning resulting in acute renal failure without hepatic coma. Nephron (1988) 50:55–56.
7. Davenport A, Will EJ, Davison AM, et al. Changes in intracranial pressure during haemofiltration in oliguric patients with grade IV hepatic encephalopathy. Nephron (1989) 53:142–146.
8. Arieff AI. Dialysis disequilibrium syndrome: current concepts on pathogenesis and prevention. Kidney Int (1994) 45:629–635.
9. Trinh-Trang-Tan MM, Carton JP, Bankir L. Molecular basis for the dialysis disequilibrium syndrome: altered aquaporin and urea transporter expression in the brain. Nephrol Dial Transplant (2005) 20:1984–1988.
10. Jones JG, Bembridge JL, Sapsford DT, et al. Continuous measurement of oxygenation saturation during haemodialysis. Nephrol Dial Transplant (1992) 7:110–116.
11. Arieff AI, Guisado R, Massry SG, et al. Central nervous system pH in uremia and the effects of hemodialysis. J Clin Invest (1976) 58:306–310.
12. Ware AJ, D’Agostino A, Coombes B. Cerebral oedema: a major complication of massive hepatic necrosis. Gastroenterol (1971) 61:877–884.
13. Davenport A, Will EJ, Losowsky MS. Rebound surges of intracranial pressure as a consequence of forced ultrafiltration used to control intracranial pressure in patients with severe hepatorenal failure. Am J Kidney Dis (1989) 14:516–519.
14. Davenport A. Intradialytic complications during hemodialysis. Hemodial Int (2006) 10:162–167.
15. Schortgen F, Soubrier N, Delclaux C, et al. Haemodynamic tolerance of intermittent haemodialysis in critically ill patients. Am J Respir Crit Care Med (2000) 162:197–202.
16. Vinsonneau C, Camus C, Combes A. Hemodiafe Study Group. Continuous venovenous haemodiafiltration versus intermittent haemodialysis for acute renal failure in patients with multiple-organ dysfunction syndrome: a multicentre randomised trial. Lancet (2006) 368:379–85.
17. Davenport A. Renal replacement therapy in the patient with acute brain injury. Am J Kidney Dis (2001) 37:457–466.
Гемодиализ специалистам
www.medservis.az/dia_doctor.htm
Нейрогенный отек легких
Нейрогенный отек легких описан при заболеваниях ЦНС у лиц без предшествующих нарушений функции левого желудочка. Экспериментально доказано, что в возникновении отека легких важную роль играет повышение симпатического тонуса, однако точные механизмы не выяснены. Известно, что возбуждение симпатических нервов вызывает спазм артериол. повышение АД и централизацию гемодинамики ; кроме того, возможно уменьшение податливости левого желудочка. Все это ведет к повышению давления в левом предсердии и отеку легких, в основе которого лежат нарушения гемодинамики. Имеются экспериментальные данные о том, что стимуляция адренорецепторов непосредственно повышает проницаемость капилляров, но этот эффект имеет меньшее значение, чем нарушение равновесия между гидростатическим и онкотическим давлением.
Нейрогенный отек легких
Гидроэнцефалия
Эпидемиология
Встречаемость: 1-1,5%.
Диагностика и интенсивная терапия острой печеночной недостаточности: что нового?
Мокнущая экзема
Источник
