Наркозное средство при гипоксическом отеке мозга
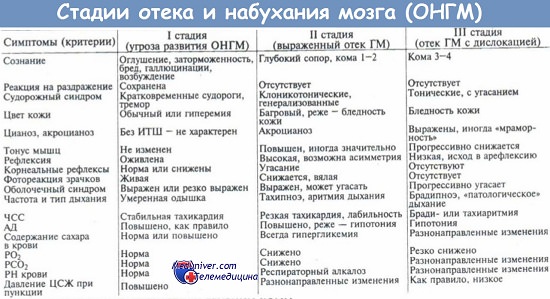
| Оглавление темы “Отек мозга. Первая помощь при отеке головного мозга. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Первая помощь при миастеническом кризе.”: 1. Отек мозга. Определение отека мозга. Причины ( этиология ) отека мозга. Патогенез отека мозга. 2. Клинические проявления отека головного мозга. Признаки отека мозга. Клиника отека мозга. Общемозговой синдром. 3. Синдром диффузного рострокаудального нарастания неврологических симптомов при отеке мозга. Дыхание Биота. Синдром дислокации мозговых структур. 4. Диагностика отека головного мозга. Принципы лечения отека мозга. 5. Неотложная помощь при отеке мозга. Первая помощь при отеке головного мозга. 6. Лечение при отеке мозга. Лечение отека головного мозга в стационаре. 7. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Причины ( этиология ) миастении. Патогенез миастении. 8. Клиника ( признаки ) миастенического криза. Клиника ( признаки ) миастении. Диагностика миастении. Диагностика миастенического криза. 9. Неотложная помощь при миастеническом кризе. Первая помощь при миастеническом кризе. Лечение при отеке мозга. Лечение отека головного мозга в стационаре.Данный вид медицинской помощи должен осуществляться в отделениях реанимации и интенсивной терапии и быть построен на нижеприведенных принципах лечения отека головного мозга (Ш. Ш. Шамансуров и др., 1995). Коррекция нарушения дыхания и сердечной деятельности. В зависимости от степени поражения ЦНС и тяжести состояния больных с тяжелыми формами отека, нарушения дыхания и сердечной деятельности могут быть первичными и вторичными. При их коррекции используются стандартные методики. Этиологическое лечение основного заболевания. Рациональное лечение отека мозга заключается в устранении самой причины, которая этот отек вызвала. Такое лечение возможно лишь тогда, когда первопричина отека точно известна. Однако даже устранение причины отека не обязательно приводит к его ликвидации. В таких случаях терапевтические воздействия необходимо направить на сам отек мозга. Следует указать, что ни один метод лечения не устранит отек вокруг опухоли, абсцесса или гематомы, если не ликвидирован первичный патологический очаг. Патогенетическая терапия отека направлена, в первую очередь, на устранение гипоксии как наиболее неблагоприятного фактора, способствующего развитию отека. Эта терапия направлена на нормализацию гемодинамики, ликвородинамики, метаболизма нейронов. Иными словами, терапия нацелена на коррекцию основных патофизиологических механизмов (циркуляторных, васкуляторных, тканевых), участвующих в развитии отека мозга. Коррекция гематоциркуляторных нарушений включает: 1. Лечебные мероприятия, направленные на нормализацию показателей системной гемодинамики. Для поддержания адекватной перфузии головного мозга необходимо сконцентрировать усилия на нормализацию системного артериального давления путем рационального назначения вазоактивных (дилататоров или констрикторов) препаратов быстрого действия (клофелин, дибазол или кофеин бензоат натрия и др.). 2. Назначение блокаторов кальциевых каналов. Эти препараты способствуют улучшению мозговой циркуляции, уменьшают накопление тканевых гормонов и тем самым обеспечивают устойчивость мозга к гипоксии. К ним относятся верапамил и его производные (финоптин, изоптин), нимодипин, лидофлазин, нифедипин (коринфар), фендилин (сензид), циннаризин (стугерон). 3. Усиление микроциркуляции мозга путем назначения препаратов, нормализующих тонус сосудов и реологические свойства крови. Здесь целесообразно использовать следующие вазоактивные препараты: кавинтон, ксантинола никотинат (компламин, теоникол, ксарин), эуфиллин, трентал (агапурин), дипиридамол (курантил), галидор, сермион (редергин), реополиглюкин, гепарин, индометацин (вольтарен, ортофен, аспирин). При коррекции васкулярного (барьерного) фактора назначают следующие препараты: • глюкокортикоиды (назначается либо преднизолон, либо дексаметазон); • ингибиторы протеолитических ферментов. Они инактивируют тканевые гормоны воспаления при отеке головного мозга (гистамин, брадикинин, трипсин и др.). Для этой цели в/в вводится контрикал в дозе 1-10 тыс. ЕД/кг, гордокс – 12-15 тыс. ЕД/кг, аминокапроновая кислота – 200-300 мг/кг/24 ч. Курс лечения ингибиторами протеолитических ферментов, как правило, не превышает 5-7 дней; • препараты, стабилизирующие клеточные мембраны и ангиопротекторы. Назначение последних способствует уменьшению проницаемости стенки сосудов мозга. К этой группе препаратов относятся дицинон, троксевазин, гливенол, венорутон, аскорутин; • блокаторы кальциевых каналов (о назначении этих препаратов сказано выше); • иммунокорригирующие препараты. В качестве иммуносупрессоров чаще всего используются стероидные гормоны (кортизон, гидрокортизон, преднизолон). Иммуностимулирующая терапия включает применение тимозина, Т-активина, В-активина, тимогена, левамизола, пропермила, витаминов группы В. Коррекция тканевого фактора включает: • обеспечение адекватной оксигенации крови. Достигается восстановлением и поддержанием проходимости дыхательных путей, проведением постоянной ингаляции увлажненного кислорода, применением в некоторых случаях гипербарической оксигенации и ИВЛ; • нормализацию метаболических процессов в нейронах головного мозга. Для этой цели используются ноотропы (ноотропил, пирацетам, ами-налон, церебролизин, энцефабол, пантогам, пиридитол и др.). Коррекция нарушений водно-электролитного обмена и дегидратационная терапия. Важным патогенетическим направлением лечения отека мозга является назначение дегидратационной терапии: • осмотические диуретики ( глицерин, маннитол, сорбитол и др.); • салуретики (лазикс, фуросемид и др.); • кортикостероиды (гидрокортизон, преднизолон). Следует указать, что действие стероидов на отек мозга развивается медленно – эффект обнаруживается не раньше, чем через 24 ч после первого введения препарата. Они более эффективны при локальных отеках мозга; кроме этого необходимо знать, что длительное применение стероидов, особенно в малых дозировках, может вызвать увеличение объема мозга и ВЧД; • барбитураты (внутримышечно 10% раствор тиопентала натрия в дозе 10 мг/кг каждые 3 ч, суточная доза детям до 80 мг/кг). Хирургическая коррекция отека мозга. Когда этиологический фактор отека мозга представлен экспансивным процессом (гематома, опухоль, абсцесс и т. д.), он может быть прерван только с помощью нейрохирургического вмешательства.
– Также рекомендуем “Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Причины ( этиология ) миастении. Патогенез миастении.” |
Источник
Для ингаляционного наркоза
жидкие летучие вещества: галотан (фторотан), энфлуран, изофлуран, севофлуран, диэтиловый эфир
газообразные вещества: закись азота, ксенон
Для неингаляционного наркоза:
А) кратковременного действия (до 15 мин) кетамин, пропофол
Б) средней продолжительности действия (20-30 мин) тиопентал-натрий, гексенал
В) длительного действия (60 мин и более) натрия оксибутират
Виды наркоза: ингаляционный, неингаляционный (в/в, в/м), мононаркоз, полинаркоз (комбинированный, смешанный, вводный, базисный, потенцированный), лечебный – для купирования болевого синдрома при инфаркте миокарда, тяжелой травме, приступе бронхиальной астмы, рауш-наркоз.
Педиатрические особенности. Дети раннего возраста более чувствительны к наркозным средствам, что связано с большей проницаемостью ГЭБ, особенностями биотрансформации препаратов, меньшей возможностью перераспределения наркозных средств в мышечную и жировую ткани. Скелетная мускулатура у них расслабляется в меньшей степени, поэтому анестетики комбинируются с миорелаксантами.
ЭФИР ДЛЯ НАРКОЗА
Обладает выраженной наркотической активностью, большой широтой наркотического действия, относительно мало токсичен, наркоз хорошо управляем. Наблюдается хорошая миорелаксация.
Недостатки: наличие выраженной стадии возбуждения продолжительностью 10-20 минут, высвобождает катехоламины и вызывает появление аритмий, увеличение глюкозы в крови, кратковременно нарушает диурез. Обладает раздражающим действием, испаряясь, оказывает охлаждающее действие и вызывает развитие бронхопневмоний. После наркоза могут появиться тошнота, рвота, запоры, у детей возможны судороги, рефлекторное урежение дыхания и ритма сердца, гиперсекреция слюнных и бронхиальных желез. Взрывоопасен, легко воспламеняется.
ГАЛОТАН
Не горит, не взрывается. Обладает высокой наркотической активностью (в 3-4 раза сильнее эфира), достаточной широтой наркотического действия, наркоз наступает через 3-5 мин, стадия возбуждения практически отсутствует, управляемый наркоз, вызывает удовлетворительную миорелаксацию, не раздражает дыхательные пути.
Недостатки: брадикардия (за счет ваготонии), сенсибилизация миокарда к катехоламинам (аритмии), оказывает гепатотоксическое и нефротоксическое действие, снижает АД и угнетает работу сердца.
ЗАКИСЬ АЗОТА
Положительные свойства: малая токсичность, большая широта НД, хорошая анальгезирующая активность, не воспламеняется, не взрывоопасна. Стадия возбуждения отсутствует.
Недостатки: обладает низкой наркотической активностью (используется в смеси с кислородом (80% и 20%)). Мало расслабляет скелетную мускулатуру. При длительном использовании возможны лейкопения, мегалобластная анемия, нейропатия.
Наиболее часто используется для рауш-наркоза или лечебного наркоза.
КЕТАМИН.
Широко применяется в детской анестезиологии.
Используется для неингаляционного наркоза. Вызывает наркоз длительностью до 15 минут в виде диссоциативной анестезии: выраженное общее обезболивание, снотворный эффект с частичной амнезией и частичной утратой сознания. Механизм действия связан с блокадой NMDA-глутаматных рецепторов, уменьшением действия ВАК. Стимулирует выделение эндорфинов и энкефалинов, является нейропротектором. Кетамин нарушает обратный захват норадреналина, серотонина, увеличивает мозговой кровоток и обмен веществ в ГМ. Скелетные мышцы не расслабляются. Кетамин увеличивает АД, силу и частоту сердечных сокращений. После операций неприятные яркие сновидения, психомоторные реакции и галлюцинации. Возможно злоупотребление в качестве галлюциногена.
Используется для кратковременных операций, введения в наркоз, в/в капельного введения для поддержания наркоза.
ТИОПЕНТАЛ НАТРИЯ, ГЕКСЕНАЛ.
При в/в введении вызывает наркоз примерно через 1 минуту без стадии возбуждения. Продолжительность наркоза 20-30 мин.
Механизм действия: взаимодействует с барбитуровыми рецепторами, которые входят в состав макромолекулярного рецепторного комплекса, вызывают аллостерические изменения в ГАМКА рецепторе – открытие хлорного канала, гиперполяризация и тормозной эффект. Вводится в/в, у детей – ректально.
Токсичен, может вызвать мышечные подергивания, ларингоспазм, при быстром введении угнетает дыхательный и сосудодвигательный центры, работу сердца. У детей младшего возраста возможны дыхательная недостаточность и повышение внутричерепного давления.
Применяется для вводного наркоза или при кратковременных оперативных вмешательствах.
НАТРИЯ ОКСИБУТИРАТ- производное ГОМК.
Преимущественно стимулирует пресинаптические ГАМКБ-рецепторы, уменьшая выделение АХ, НА и других медиаторов. В малых дозах оказывает снотворный и успокаивающий, в больших – противосудорожный и наркотический эффекты. Обладает ноотропной активностью, выраженным антигипоксическим действием (повышает устойчивость тканей к кислородной недостаточности). Наркоз наступает через 30-40 мин и продолжается 2-3 часа.
Препарат можно вводить в/в, в/м, внутрь. Используется для вводного и базисного наркоза, для обезболивания родов, при гипоксическом отеке мозга, в качестве противошокового средства, с целью успокаивающего и снотворного действия.
Соседние файлы в папке лекции по фарме
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Средства для наркоза, оказывая угнетающее влияние на центральную нервную систему, вызывают временную утрату сознания, угнетение всех видов чувствительности, снижение мышечного тонуса и рефлекторной активности при умеренном торможении жизненно важных центров продолговатого мозга. Препараты этой группы имеют важное значение для хирургии, развитие которой тесно связано с усовершенствованием обезболивания. Любая операция сопровождается сильными болевыми ощущениями, которые при недостаточном обезболивании могут вести к развитию болевого шока и гибели пациента. Средства для наркоза позволяют полностью снять болевые ощущения и их негативное влияние на организм, получить наиболее эффективное хирургическое обезболивание.
Впервые общий анестетик (азота закись) был применен Уэллсом в 1844 году при удалении зубов, но датой открытия наркоза считают 1886 год, когда Мортон публично продемонстрировал наркотическое действие эфира диэтилового. Известный хирург Н.И.Пирогов в том же году организовал массовое применение эфира перед операциями на поле боя.
По способу введения в организм все наркозные средства можно разделить на средства для ингаляционного наркоза, вводимые в организм через дыхательные пути, и для неингаляционного наркоза, вводимые, как правило, внутривенно.
Механизм действия наркозных препаратов заключается в блокаде межнейронной (синаптической) передачи возбуждения в центральной нервной системе. Единой теории, объясняющей их влияние на синаптическую передачу, нет. Данный эффект связывают с физико-химическими свойствами препаратов (способностью растворяться в липидах, содержание которых в нервной ткани повышено, нарушать окислительные процессы, адсорбироваться на мембране нервных клеток, образовывать нестойкие связи с белками нейронов центральной нервной системы, формировать с водой кристаллогидраты и т.д.). Несмотря на различие в биохимическом и физико-химическом механизме действия, все наркозные средства влияют на мембрану нейронов, изменяя ее проницаемость для ионов натрия и калия, нарушая процесс деполяризации. Это препятствует возникновению потенциала действия, в результате блокируется межнейронная передача возбуждения. Возможно, некоторые препараты действуют на пресинаптическом уровне, нарушая освобождение медиаторов, обусловливающих межнейронные контакты. В зависимости от химического строения и физико-химических свойств различные препараты имеют особенности влияния на нейроны, что отражается на их фармакодинамике. Чувствительность синапсов различных отделов центральной нервной системы к наркозным средствам неодинакова: наиболее чувствительны к действию химических агентов синапсы восходящей активирующей системы ретикулярной формации ствола мозга и коры головного мозга, наиболее устойчивы – жизненно важные центры продолговатого мозга. Это обусловливает наличие нескольких периодов в течение наркоза – выделяют 4 основные стадии, выраженность которых может варьировать в зависимости от особенности действия отдельных общих анестетиков.
Сразу после введения в организм наркозного препарата развивается стадия анальгезии или оглушения (первая стадия). Она характеризуется резким снижением болевой чувствительности, спутанностью сознания, но контакт с пациентом сохраняется. Хотя продолжительность стадии анальгезии невелика (5-10 мин), она может использоваться для проведения кратковременных операций. Стадию анальгезии можно удлинить, используя перед наркозом (премедикация) болеутоляющие и успокаивающие средства и поддерживая во вдыхаемом воздухе определенную концентрацию наркозного вещества.
В стадии возбуждения (вторая стадия) наблюдается полное выключение сознания, двигательное и речевое возбуждение, значительные колебания артериального давления, ритма сердца и дыхания. Возникновение этой стадии объясняется полным угнетением коры и снятием ее тормозящего влияния на нижележащие отделы, что сопровождается вторичным возбуждением подкорковых структур и повышением рефлекторной деятельности. В этот период нельзя проводить каких-либо хирургических вмешательств, так как возможна остановка дыхания, фибрилляция и остановка сердца.
В стадии хирургического наркоза (третья стадия) угнетение коры, подкорковых образований и спинного мозга приводит к полной утрате сознания, чувствительности, рефлексов, расслаблению скелетной мускулатуры, нормализуется артериальное давление, урежается пульс, дыхание становится ритмичным, поскольку сохраняется функция жизненно важных центров продолговатого мозга. Большинство хирургических вмешательств проводится в этой стадии.
Сразу после прекращения вдыхания наркозного средства начинается стадия пробуждения, при этом функции центральной нервной системы восстанавливаются в обратной последовательности. При передозировке наркозных препаратов наблюдается глубокое угнетение жизненно важных центров продолговатого мозга, нарушается дыхание и кровообращение, резко расширяются зрачки, смерть наступает от паралича дыхательного центра и остановки дыхания.
В чистом виде мононаркоз в настоящее время применяется редко. Для более быстрого введения в наркоз и уменьшения осложнений от применения общих анестетиков используется комбинированный и смешанный наркоз, а для подготовки к операции проводится премедикация – пациенту назначают успокаивающие и болеутоляющие препараты. При смешанном наркозе используют сочетание некоторых средств для наркоза (например, эфир, фторотан и закись азота), что позволяет снизить дозу каждого из них, а следовательно, и токсичность. Комбинированный наркоз основан на сочетании неингаляционного и ингаляционного наркоза. Современный уровень развития анестезиологии (науки, изучающей возможные варианты обезболивания) позволяет подбирать индивидуальную схему премедикации и наркоза для каждого пациента с учетом его общего состояния, характера заболевания и планируемого объема хирургического вмешательства. Наркотизирование проводит врач- анестезиолог, который должен в совершенстве владеть приемами реаниматологии, то есть восстановления утраченных жизненных функций, что может наблюдаться во время наркотизирования и проведения операций. Врач-анестезиолог должен не только снять боль, но и позволить хирургу провести операцию с наименьшими нарушениями функций различных органов и систем, с наименьшими затратами жизненных сил организма пациента. Активность общих анестетиков повышается введением успокаивающих и болеутоляющих препаратов. Для расслабления скелетной мускулатуры используют миорелаксанты, для устранения отрицательных вагусных рефлексов применяют М-холиноблокаторы (атропин и другие). При необходимости в предоперационную терапию включают сердечно-сосудистые, антигистаминные и другие препараты.
К средствам для наркоза предъявляют определенные требования. Они должны иметь высокую наркотическую активность, обеспечивать хорошую управляемость наркозом, то есть давать быстрое введение (желательно без стадии возбуждения) и выведение из наркоза. хорошую регулируемость его глубины, малую токсичность, большую широту наркотического действия, т.е. достаточный диапазон между концентрацией препарата в крови, вызывающей стадию наркоза, и концентрацией, вызывающей угнетение жизненно важных центров продолговатого мозга.
- 2.1.3.1.1. Средства для ингаляционного наркоза
- 2.1.3.1.2. Средства для неингаляционного наркоза
Источник
